1. Gesetzlicher Auftrag
Die
Gentechnikkommission hat gemäß § 99 Abs. 5 Gentechnikgesetz - GTG (BGBl.
Nr. 510/1994,
i.d.F. BGBl. I Nr. 126/2004) auf der Grundlage der ihr von den ständigen wissenschaftlichen
Ausschüssen übermittelten Berichte in dreijährigen Abständen - erstmals 1998 ‑
einen Bericht über die Anwendungen der Gentechnik in Österreich zu erstellen.
Dieser Bericht
ist vom Bundesminister für Gesundheit und Frauen im Einvernehmen mit dem
Bundesminister für Bildung, Wissenschaft und Kultur unter Beifügung einer
Darstellung der von diesen beiden Ministern getroffenen Maßnahmen zur Förderung
der Sicherheitsforschung (§ 102 GTG) dem Nationalrat vorzulegen.
Der erste
Bericht wurde am 14. Jänner 1999 von der Gentechnikkommission beschlossen und
dem Nationalrat vorgelegt. Er umfasste den Zeitraum vom Inkrafttreten des
Gentechnikgesetzes am 1. Jänner 1995 bis zum 1. Juni 1998.
Der zweite
Bericht über den Zeitraum vom 1. Juni 1998 bis zum 1. Juni 2001 wurde am 15.
April 2002 von der Gentechnikkommission beschlossen und dem Nationalrat
vorgelegt.
Der nun
vorliegende dritte Bericht umfasst den Zeitraum vom 1. Juni 2001 bis zum 1.
Juni 2004 und enthält in Übereinstimmung mit § 99 Abs. 5 GTG eine
zusammenfassende Darstellung
a) der in Österreich durchgeführten Arbeiten
mit GVO in geschlossenen Systemen,
b) des Bereiches des Freisetzens von GVO und Inverkehrbringens von Erzeugnissen gemäß dem III. Abschnitt und
c) allgemeiner Angelegenheiten der in Österreich durchgeführten Genanalysen und Gentherapien am Menschen.
Die dabei
beobachteten Entwicklungen im Hinblick auf die Beachtung der in
§ 3 GTG festgehaltenen Grundsätze (Vorsorgeprinzip, Zukunftsprinzip,
Stufenprinzip, demokratisches Prinzip und ethisches Prinzip) werden von der
Gentechnikkommission bewertet und
die bildungs‑ und forschungspolitischen und wirtschaftlichen Konsequenzen der
beobachteten Entwicklung für Österreich untersucht und dargestellt. In einem
kurzen Exkurs werden auch die Entwicklungen auf EU-Ebene beleuchtet.
2. Aufgaben
und Tätigkeit der Gentechnikkommission
Die Gentechnikkommission
und ihre drei wissenschaftlichen Ausschüsse sind beim Bundesministerium für
Gesundheit und Frauen zur Beratung der Behörde über grundsätzliche Fragen der
Anwendungen der Gentechnik eingerichtet. Des weiteren obliegt der
Gentechnikkommission die Beschlussfassung über vorgeschlagene Abschnitte des
Gentechnikbuches, in dem der Stand von Wissenschaft und Technik für alle
gesetzlich vorgesehenen Bereiche des Einsatzes der Gentechnik in Österreich zu
dokumentieren ist. Für die laufenden Geschäfte der Gentechnikkommission und
ihrer Ausschüsse ist beim Bundesministerium für Gesundheit und Frauen eine
Geschäftsstelle eingerichtet.
Die Aufgaben
der Gentechnikkommission sind insbesondere
a)
die
Beratung der Behörde über grundsätzliche Fragen der Anwendungen der Gentechnik,
soweit sie nicht in den Aufgabenbereich der wissenschaftlichen Ausschüsse
fallen,
b)
die
Beschlussfassung über vorgeschlagene Abschnitte des Gentechnikbuches und
c)
die
Erstellung des Berichts über die Anwendung der Gentechnik.
Den
wissenschaftlichen Ausschüssen obliegt die Begutachtung von Anmeldungen und
Anträgen nach Maßgabe des GTG sowie die Vorbereitung von Abschnitten des
Gentechnikbuches und die Abgabe von Stellungnahmen zu Verordnungsentwürfen nach
Maßgabe des GTG.
2.1.
Tätigkeit der Gentechnikkommission und ihrer wissenschaftlichen Ausschüsse
2.1.1.
Gentechnikkommission
Die
Gentechnikkommission trat im Berichtszeitraum zu insgesamt fünf Sitzungen
zusammen. Wichtigste Tagesordnungspunkte dieser Sitzungen waren:
13. Sitzung
am 19. Februar 2002:
Erörterung des
Vorschlages für den 2. Bericht der Gentechnikkommission an den Nationalrat;
Bericht über
den Stand der 2. Novelle zum Gentechnikgesetz mit dem Schwerpunkt der Umsetzung
der Richtlinie 98/81/EG.
14.
Sitzung am 15. April 2002:
·
Erörterung
und Beschlußfassung des 2. Berichtes der Gentechnikkommission an den
Nationalrat gemäß § 99 Abs. 5 GTG;
·
Erörterung
der Berichte der drei wissenschaftlichen Ausschüsse der Gentechnikkommission
für das Kalenderjahr 2001.
15.
Sitzung am 24. Juni 2002:
·
Erörterung
und Beschlußfassung der „Leitlinien für die genetische Beratung“ als 2. Kapitel
des Gentechikbuches gemäß § 99 Abs. 2 GTG
16.
Sitzung am 30. Juni 2003:
·
Erörterung
der Berichte der drei wissenschaftlichen Ausschüsse der Gentechnikkommission
für das Kalenderjahr 2002;
·
Bericht
über legistische Vorhaben (Regelungen zur Frage der Koexistenz, Umsetzung der
Richtlinie 2001/18/EC, Anpassung des IV. Abschnittes des GTG an den Stand von
Wissenschaft und Technik);
·
Bericht
über die bevorstehende Neubestellung der wissenschaftlichen Ausschüsse für
deren 3. Funktionsperiode
17. Sitzung am 10. Februar 2004:
·
Österreichische
Importverbote für drei GVO-Maise (Stand des WTO-Verfahrens, Argumente für die
Beibehaltung der österreichischen Maßnahmen);
·
Bericht
über den Stand der Novelle zum GTG zur Umsetzung der Freisetzungsrichtlinie
Neukonstituierung der
wissenschaftlichen Ausschüsse der Gentechnikkommission
·
·
Mit
31. Oktober 2003 endete die zweite Funktionsperiode der Mitglieder der wissenschaftlichen
Ausschüsse. Die Neukonstituierung der genannten Ausschüsse erfolgte mit 1. November 2003. Die Liste aller
auf Grund der öffentlichen Ausschreibung gemäß § 89 Abs. 3 GTG eingelangten
Bewerbungen, die Nominierungen und Dreiervorschläge der Österreichischen
Akademie der Wissenschaften für die Besetzung dieser Ausschüsse sowie die Begründung
für deren Erstellung ist diesem Bericht
als Anlage 1 beigeschlossen
(siehe § 89 Abs. 5 GTG).
·
·
Anlage
2 beinhaltet ein komplettes Verzeichnis der Mitglieder der Gentechnikkommission
und der drei wissenschaftlichen Ausschüsse (Stand 1. Juni 2004).
2.1.2.
Wissenschaftlicher Ausschuss für Arbeiten im geschlossenen System
Der
wissenschaftliche Ausschuss für Arbeiten im geschlossenen System hielt im
Berichtszeitraum vier Sitzungen ab. Dabei standen folgende Themen auf der
Tagesordnung:
·
3. Sitzung am 30. Oktober 2001:
·
Begutachtung
eines Antrages für Arbeiten mit GVO im geschlossenen System in Sicherheitsstufe
3; Erörterung von Sicherheitsfragen bei gentechnischen Arbeiten mit Patientenblut.
·
·
4. Sitzung am 11. März 2002:
·
·
Erörterung
von Sicherheits- und Einstufungsfragen im Zusammenhang mir einer Arbeit mit GVO
in Sicherheitsstufe 2 der Veterinärmedizinischen Universität Wien; Bericht über
den Stand der Novelle des GTG zur Umsetzung der Systemrichtlinie 98/81/EG.
·
·
5. Sitzung am 18. Juli 2002:
·
·
Anhörung
des Ausschusses zum Entwurf der neuen Systemverordnung (Systemverordnung 2002)
zur Umsetzung der Richtlinie 98/81/EG; Bericht über ein Workshop in der
Slowakei „Implementation of National Biosafety Frameworks in pre-acession
countries of Cetral and Eastern Europe“ mit dem Ziel, die östlichen
EU-Beitrittskandidaten bei der Umsetzung und Vollziehung der EU-Richtlinien im
Bereich Gentechnik zu unterstützen.
·
·
6. Sitzung am 2. Dezember 2002:
·
·
Begutachtung
eines Antrages auf Genehmigung zur Durchführung von zwei Arbeiten mit GVO in
Sicherheitsstufe 3; Bericht über die vom BMSG durchgeführten Kontrollen gemäß §
101 GTG von Arbeiten mit GVO in gentechnischen Anlagen; Bericht über das
Inkrafttreten der Systemverordnung (BGBl. II Nr. 43/2002) am 1.12.2002.
·
2.1.3.
Wissenschaftlicher Ausschuss für Freisetzungen und Inverkehrbringen
Im
Berichtszeitraum fanden zwei Sitzungen des wissenschaftliches Ausschusses für
Freisetzungen und Inverkehrbringen statt, in denen folgendes erörtert wurde:
·
3. Sitzung am 11. Juni 2003:
·
·
Bericht
und Diskussion über eine Mitteilung von Kommissar Fischler zur Frage der „Koexistenz“;
Bericht über aktuelle Forschungsprojekte zu Fragen der Koexistenz und der ökologischen
Sicherheitsbewertung; Bericht über den Stand der Novelle zum Gentechnikgesetz
mit dem Schwerpunkt der Umsetzung der Richtlinie 2001/18/EG; Bericht über zwei
Entscheidungen der Kommission bzw. des Rates (Leitlinien zur Ergänzung der
Anhänge II und VII der Richtlinie 2001/18/EG: betreffend die Risikobewertung
und die Überwachung von In Verkehr gesetzten GVO-Produkten).
·
·
konstituierende Sitzung für die 3. Funktionsperiode am 25. Mai 2004:
·
·
Konstituierung,
Wahl der Berichterstatter und der Vertreter des Ausschusses in der Gentechnikkommission;
Bericht über Aktivitäten des BMGF im Zusammenhang mit der European Food Safety
Authority (EFSA); Stand der legistischen Arbeiten bei der Neuerlassung der
Freisetzungsverordnung; Bericht über die Studie von DI Werner Müller über
GVO-Soja und –Mais; Entscheidung der Europäischen Kommission über die Zulassung
von Bt11-Süßmais als Lebensmittel;
2.1.4.
Wissenschaftlicher Ausschuss für Genanalyse und Gentherapie am Menschen
Dieser
Ausschuss hielt im Berichtszeitraum sechs Sitzungen ab:
·
7.
Sitzung am 21. Jänner 2002
·
8.
Sitzung am 12. April 2002
·
9.
Sitzung am 11. Juni 2002
·
10.
Sitzung am 1. Oktober 2002
·
11.
Sitzung am 1. April 2003
·
12.
Sitzung am 30. Oktober 2003
Neben
der gesetzlich vorgesehenen Begutachtung von Anträgen gemäß dem IV. Abschnitt
des GTG, die unter Punkt 3.3. des Berichts behandelt werden, wurden unter
anderem folgende Themen erörtert:
Für
den Bereich der Genanalyse am Menschen:
·
Der
Bereich der Gendiagnostik am Menschen kristallisierte sich in diesem
Berichtszeitraum als Schwerpunkt der Arbeit des wissenschaftlichen Ausschusses
heraus.
·
Zum
einen war durch die Vielzahl an Anträgen auf Zulassung von Einrichtungen zur
Durchführung von Genanalysen aus ganz Österreich ein Hauptaugenmerk auf die
Begutachtung dieser Anträge zu legen. Zum anderen ergaben sich im Lichte der
ständig fortschreitenden technischen und wissenschaftlichen Entwicklung auf dem
Gebiet der Gendiagnostik zahlreiche Fragestellungen, die über den Anlaßfall der
Antragstellung hinaus zu eingehenden Diskussionen im Ausschuss führten.
·
·
In
diesem Zusammenhang ist vor allem die Verwendung der DNA-Chip-Technologie zu
nennen, die wiederholt erörtert wurde. Die Frage der medizinischen Aussagekraft
mancher in dieser Form angebotenen Untersuchungen wurde thematisiert, ebenso
der Umstand, dass diese Methode sehr umfangreiche Analysen ermöglicht und zur
Entstehung von Überschussinformation und oft schwer interpretierbaren
Ergebnissen beiträgt. Deshalb seien an zuweisende Ärzte, aber auch an die
durchführenden Labors und die Personen, die zur Aufklärung und Beratung der
Probanden autorisiert sind, andere Anforderungen zu stellen, als bei der
Durchführung herkömmlicher Einzelanalysen.
·
·
Trotz
einiger Meinungsunterschiede der Mitglieder in Detailfragen herrschte im
wesentlichen Einigkeit darüber, dass die Chip-Technologie derzeit stets noch
Elemente der wissenschaftlichen Forschung bei gleichzeitiger kommerzieller
Nutzung beinhalte, woraus sich viele Fragen und Probleme ergeben. Eine zu
großzügige gesetzliche und organisatorische Regelung könnte Anlass zu
missbräuchlichem Einsatz geben, eine zu strenge und restriktive Zulassung der
Technik wertvolle Forschungsarbeit behindern. Auch die bisherige strikte
Trennung zwischen Analysen zur Feststellung einer Disposition und solchen zur
Diagnose manifester Erkrankungen sei in dieser Form nicht mehr handhabbar, da
die Erfahrungen der Praxis der letzten Jahre ein Ineinanderübergreifen dieser
beiden Bereiche gezeigt haben.
·
·
Weiters
wurde auch die Finanzierbarkeit der neuen Technologie, die Frage des Kostenersatzes
durch Träger von Krankenversicherungen, die Gefahr eines zu weitreichenden und
unreflektierten Einsatzes in Form von Screening-Untersuchungen und die
Bedeutung von qualitativer Aufklärung und Beratung im Lichte moderner
Werbemöglichkeiten (vor allem via Internet) erörtert.
·
·
Ein
weiteres Diskussionsthema war die Durchführung von Screening-Untersuchungen an
Neugeborenen, dabei im besonderen die Frage, welche Anforderungen an die
ärztliche Aufklärung zu stellen sind, wenn sich im Anschluß an eine „herkömmliche“
Routine- Untersuchung im Rahmen eines Screening-Programmes die Notwendigkeit
einer genaueren Abklärung der Diagnose durch eine Genanalyse ergibt. Hier
vertrat der Ausschuss die Meinung, dass auch derartige Analysen wie alle
Genanalysen erst durchgeführt werden dürfen, wenn die Betroffenen über Wesen,
Tragweite und Aussagekraft der Analyse informiert wurden und der Untersuchung
zugestimmt haben. Dabei wurde angeregt, die Information der Betroffenen durch
Bereitstellung von geeignetem schriftlichen Material in Form von Broschüren
bzw. Aufklärungsfoldern zu gewährleisten.
·
·
Arbeitskreis „Beratung“
·
·
Die
von der Arbeitsgruppe „Genetische Beratung“ in den Jahren 1999 bis 2002 ausgearbeiteten
„Leitlinien für die genetische Beratung“ wurden in den Sitzungen des wissenschaftlichen
Ausschusses am 21. Jänner 2002, am 12. April 2002 und am 11. Juni 2002
erörtert. Es erfolgten einige Änderungen sowie die Zusammenstellung einer
„Beispielliste für humangenetische Fragestellungen, bei denen eine
psychotherapeutische Beratung im Zusammenhang mit prädiktiver Gendiagnostik
allgemein anzuraten wäre“, die als Anhang angeschlossen wurde. Danach wurde der
Text von der Mehrheit der Ausschussmitglieder angenommen und der
Gentechnikkommission gemäß § 99 Abs. 2 GTG zur Beschlussfassung als Kapitel des
Gentechnikbuches vorgeschlagen. Die Beschlußfassung durch die Gentechnikkommission
erfolgte am 24.6.2002. Veröffentlicht wurden die „Leitlinien“ in den „Mitteilungen
der Sanitätsverwaltung“ vom Juli 2002, 103. Jahrgang/Heft 7, Seiten 3 und 4 sowie
auf der Gentechnik-Homepage des Ressorts unter www.gentechnik.gv.at im Menü unter
„Rechtsvorschriften in Österreich“.
·
·
Die
„Leitlinien“ regeln Umfang und Inhalt einer genetischen Beratung vor und nach
Durchführung einer Genanalyse, die Möglichkeit der Beiziehung eines
Psychotherapeuten, das Recht auf Wissen bzw. Nicht-Wissen des Untersuchten über
die Ergebnisse der Untersuchung, den Datenschutz, die Verschwiegenheitspflicht
der Beratenden sowie die erforderliche Qualifikation der Beratenden
einschließlich der Verpflichtung zu regelmäßiger Fortbildung.
·
Arbeitsgruppe
„Gentechnik – Medizin“
·
·
Im
Lichte der raschen wissenschaftlichen und technischen Weiterentwicklung auf dem
Gebiet der medizinischen Anwendungen der Gentechnik, im besonderen der
Gendiagnostik, wurde vom wissenschaftlichen Ausschuss im Herbst 2002 der
Arbeitskreis „Gentechnik – Medizin“ eingesetzt. Die konstituierende Sitzung des
Arbeitskreises fand am 19. Dezember 2002 statt, weitere sechs Sitzungen
folgten.
·
Das
Gremium setzte sich aus Mitgliedern des Ausschusses und externen Experten zusammen
und war aufgerufen, eine Bestandsaufnahme zu machen, welche neuen Aspekte und
Fragestellungen sich auf diesem Gebiet seit Inkrafttreten des GTG ergeben
haben. Ausgehend von dieser Evaluierung wurden die bestehenden Bestimmungen auf
deren Anwendbarkeit geprüft und Vorschläge für eine Anpassung des
Rechtsbestandes an den technischen Fortschritt und die gegenwärtigen
Anforderungen der biomedizinischen Praxis erarbeitet.
·
·
Dabei
wurde verstärkt an eine Nutzung des Gentechnikbuches gedacht, dessen Zweck es
ist, den aktuellen Stand von Wissenschaft und Technik zu dokumentieren.
·
Von den Teilnehmern wurde ein großer Handlungsbedarf für
die Erörterung folgender Themen gesehen: eine dem Stand von Wissenschaft und
Technik angepasste neue Definition des Begriffes „Genanalyse“, die Untersuchung
von Polymorphismen, der Umgang mit Massenuntersuchungen, im speziellen die damit
in Zusammenhang stehende genetische Beratung und die Versendung von Proben (vor
allem ins Ausland), die Pharmakogenetik, eine Differenzierung der Beratung und
eine Erweiterung und Differenzierung der Datenschutzbestimmungen.
Die vorläufigen Ergebnisse der Arbeitsgruppe werden bei
der gegenwärtig in Arbeit befindlichen Novelle zum GTG berücksichtigt.
Sonstige Aktivitäten:
·
Am
11.6.2002 fand im Anschluss an die neunte Sitzung des wissenschaftlichen Ausschusses
für Genanalyse und Gentherapie am Menschen ein Vortrag von Herrn Univ. Prof.
Dr. Hans-Martin Sass vom Zentrum für Medizinische Ethik an der Ruhr-Universität
in Bochum statt. Unter dem Thema „Ethische Aspekte neuer
Technologien in der molekularen Diagnostik“ behandelte Prof. Sass in seinem
Vortrag die Bereiche Pharmakogenetik und Arzneimittelsicherheit, die Chancen
und Risken der Verwendung von individuellen Patienten-Chipkarten, den
erweiterten Zugang der Bevölkerung zu medizinischer Information durch
verstärkte Nutzung des Internets, die Patientenaufklärung im Bereich der
prädiktiven Diagnostik, das Spannungsfeld zwischen Datenschutz und
Datenverfügbarkeit, weiters auch die Problematik von Screeninguntersuchungen
und daran anknüpfend die Präimplantationsdiagnostik, und schließlich auch die
Frage neuer Finanzierungsmodelle für Gesundheits- und Krankheitsvorsorge im
Lichte innovativer medizinischer Methoden.
·
·
Die
Veranstaltung sollte als Impuls für die weitere Arbeit des wissenschaftlichen
Ausschusses, im speziellen des Arbeitskreises „Gentechnik-Medizin“ verstanden
werden, da die von Prof. Sass angesprochenen Themen bereits wiederholt zur
Diskussion standen und auf Grund ihrer Aktualität bei der Erarbeitung neuer
gesetzlicher Regelungen mitberücksichtigt werden müssen.
2.1.5.
Gutachtertätigkeit
Auf
die Gutachtertätigkeit der wissenschaftlichen Ausschüsse wird im 3. Abschnitt
dieses Berichtes eingegangen.
3.
Zusammenfassende Darstellung der Anwendungen der Gentechnik in
Österreich
3.1.
Arbeiten mit GVO in geschlossenen Systemen
Die
Durchführung von Arbeiten mit GVO in geschlossenen Systemen ist nach Maßgabe
der §§ 19 und 20 GTG anmelde- bzw. genehmigungspflichtig. Behörde ist,
soweit diese Arbeiten mit GVO in wissenschaftlichen Hochschulen oder in
wissenschaftlichen Einrichtungen des Bundes in seinem Ressortbereich oder durch
diese erfolgen, der Bundesminister für Bildung, Wissenschaft und Kultur, im
übrigen der Bundesminister für Gesundheit und Frauen (§ 100 GTG).
Tabelle 1[1]:
Neue
Anmeldungen bzw. neue Anträge auf Genehmigung von Arbeiten mit GVO im
Berichtszeitraum 1. Juni 2001 bis 1. Juni 2004:
·
|
|
BMBWK
(vormals
BMWV) [2] |
BMGF
(vormals
BMSG)[3] |
Gesamt |
||
|
Sicherheitsstufe |
kleiner
Maßstab |
großer
Maßstab |
kleiner
Maßstab |
großer
Maßstab |
|
|
1 |
157 |
0 |
23 |
7 |
187 |
|
2 |
29 |
0 |
24 |
0 |
53 |
|
3 |
2 |
0 |
1 |
0 |
3 |
|
4 |
0 |
0 |
0 |
0 |
0 |

Tabelle
2:
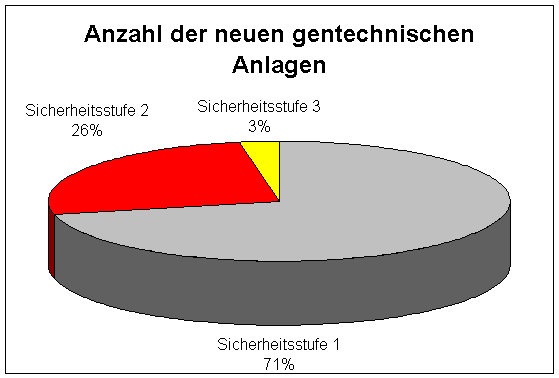
Neue gentechnische Anlagen im Berichtszeitraum 1. Juni 2001 bis 1.
Juni 2004:
Die Aufgliederung richtet
sich nach der jeweils höchsten Sicherheitsstufe der in der gentechnischen
Anlage durchgeführten Arbeiten mit GVO, wobei mit diesen Daten auch Arbeiten
mit GVOs in niedrigeren Sicherheitsstufen in derselben Anlage miterfasst sind.
|
Sicherheitsstufe |
BMBWK
(vormals
BMWV) |
BMGF (vormals BMSG) |
Gesamt |
|
1 |
16 |
9 |
25 |
|
2 |
5 |
4 |
9 |
|
3 |
1 |
0 |
1 |
|
4 |
0 |
0 |
0 |
·
Tabelle 3:
Gesamtanzahl der Anmeldungen bzw. Anträge auf
Genehmigung von Arbeiten mit GVO
seit 1. Jänner 1995:
|
|
BMBWK
(vormals BMWV) |
BMGF
(vormals BMSG) |
Gesamt |
||
|
Sicherheitsstufe |
kleiner
Maßstab |
großer
Maßstab |
kleiner
Maßstab |
großer
Maßstab |
|
|
1 |
381 |
1 |
89 |
34 |
505 |
|
2 |
117 |
0 |
60 |
1 |
178 |
|
3 |
4 |
0 |
2 |
0 |
6 |
|
4 |
0 |
0 |
0 |
0 |
0 |
·
Tabelle 4:
Gesamtanzahl der Anlagen seit 1. Jänner 1995:
·
|
Sicherheitsstufe |
BMBWK
(vormals
BMWV) |
BMGF (vormals BMSG) |
Gesamt |
|
1 |
93 |
26 |
119 |
|
2 |
42 |
12 |
54 |
|
3 |
3 |
1 |
4 |
|
4 |
0 |
0 |
0 |
Zusammenfassend
kann festgehalten werden, dass in den ersten beiden Jahren nach dem
Inkrafttreten des Gentechnikgesetzes mit 1. Jänner 1995 eine große Anzahl an
Anmeldungen und Anträgen zu bearbeiten war. In den folgenden Jahren war ein rückläufiger
Trend zu beobachten. Im nun aufgezeigten Berichtszeitraum ist wiederum –
bedingt durch die Neuansiedlung von Betrieben - ein Anstieg an angemeldeten
bzw. beantragten Arbeiten zu verzeichnen. Vor allem im privaten Sektor kann
festgestellt werden, dass sich die Anzahl der angemeldeten Arbeiten in der
Sicherheitsstufe 2 immer mehr an die der Sicherheitsstufe 1 annähert. Dies ist unter anderem darauf
zurückzuführen, dass weitere Arbeiten der Sicherheitsstufe 1 nicht
meldepflichtig sind, andererseits aber auch darauf, dass die meisten neu
angesiedelten Betriebe (spin-offs) sich hauptsächlich mit medizinischen
Forschungsthemen beschäftigen und daher zumeist mit humanpathogenen Organismen
der Risikogruppe 2 arbeiten.
·
·
Vor
der Entscheidung der Behörde über Anmeldungen und Anträge gemäß dem II. Abschnitt
des GTG waren in den in § 22 Abs. 3 GTG genannten Fällen Gutachten des wissenschaftlichen
Ausschusses für Arbeiten mit GVO im geschlossenen System einzuholen. Der
Ausschuss erstellte demgemäß positive Gutachten bei drei Anträgen auf
Genehmigung von erstmaligen Arbeiten in Sicherheitsstufe 3 im kleinen Maßstab.
·
·
Die
im Berichtszeitraum durchgeführten Kontrollen durch die Behörde ergaben keine Beanstandungen.
·
·
·
3.2. Freisetzen von GVO und Inverkehrbringen von Erzeugnissen
·
·
Jede
Freisetzung von GVO sowie das Inverkehrbringen von Erzeugnissen, die aus GVO
bestehen oder solche enthalten, bedarf der Genehmigung durch die Behörde.
·
·
3.2.1. Freisetzungen
Im Berichtszeitraum wurde weder
beim Bundesministerium für Gesundheit und Frauen noch beim Bundesministerium
für Bildung, Wissenschaft und Kultur ein Antrag auf Genehmigung zur Freisetzung
von gentechnisch veränderten Organismen gemäß dem III. Abschnitt des GTG gestellt.
·
·
3.2.2. Inverkehrbringen von Erzeugnissen, die aus GVO bestehen oder
solche enthalten
·
·
Im
Berichtszeitraum wurde in Österreich kein Antrag auf Inverkehrbringen gemäß
Teil B des III. Abschnitts des GTG gestellt. Der Genehmigung des
Inverkehrbringens durch die österreichischen Behörden stehen gemäß
§ 54 Abs. 4 GTG Genehmigungen zum Inverkehrbringen gleich, die von
Behörden anderer EU-Mitgliedstaaten im Verfahren gemäß der Richtlinie
90/220/EWG erteilt worden sind. Diese Erzeugnisse sind im Gentechnikregister
erfasst, das laufend aktualisiert wird. Ein auf dem letzten Stand befindliches
Exemplar des Gentechnikregisters gemäß § 101c GTG ist diesem Bericht
angeschlossen (Anlage 4).
·
Seit
den letzten Zulassungen gentechnisch veränderter Nutzpflanzen im Jahre
1998herrschte bezüglich der Neuzulassung eine Pattstellung („De
facto-Moratorium“). Dieses wurde beim EU-Umweltministerrat am 29. Oktober 2001
bestätigt, als sich ein Großteil der Mitgliedstaaten dafür aussprach, bis auf
weiteres keine weiteren Zulassungen für das Inverkehrbringen von Produkten
gemäß Teil C der Richtlinie 90/220/EG zu erteilen, solange
·
a)
die
Änderung der Richtlinie 90/220/EG (2001/18/EG) noch nicht umgesetzt,
b)
die
Verordnungen über die Rückverfolgbarkeit und Kennzeichnung genetisch
veränderter Organismen noch nicht angenommen und
c)
Leitlinien
für die Risikobewertung und für Monitoring-Pläne noch nicht fertiggestellt
seien.
Die Frist zur
Umsetzung der RL 2001/18/EG endete im Oktober 2002. Bis zu diesem Zeitpunkt
hatte allerdings eine Mehrzahl der EU-Mitgliedstaaten keine Umsetzungsmaßnahmen
getroffen, weil man auch noch die Fertigstellung der beiden EU-Verordnungen
über genetisch veränderte Lebens- und Futtermittel sowie über die
Rückverfolgbarkeit und Kennzeichnung von GVO abwarten wollte. Diese
Verordnungen (EG) 1829/2003 und (EG) 1830/2003 sind am 18. April 2004 in Kraft
getreten. Weiters wurden im Jahr 2003 u.a. auch die EU-Entscheidungen
betreffend Leitlinien für die Risikobewertung und für die Überwachung verabschiedet.
Im Hinblick auf das nunmehr nach Ansicht der Kommission abgeschlossene
EU-Regelwerk betreffend die Zulassung und Kennzeichnung von GVO beendete die
Kommission einseitig das Moratorium insoferne, als sie am 19. Mai 2004 den Mais
(Zuckermais) BT11 für den Import zu Nahrungsmittelzwecken zuließ, obwohl sich
eine Reihe von Mitgliedstaaten (darunter auch Österreich) bei der Abstimmung am
Landwirtschaftsministerrat gegen diese Zulassung aussprach und diese
Entscheidung daher im Rat auch nicht die erforderliche Mehrheit erhielt. (Gemäß
einer Aussendung des Zulassungsinhabers Fa. Syngenta sei allerdings bis auf
weiteres ein Inverkehrbringen dieses Produkts mangels Akzeptanz der
europäischen Konsumenten nicht beabsichtigt.)
Einen weiteren
Schritt zur Beendigung des Moratoriums setzte die Kommission am 19. Juli 2004,
als sie, ebenfalls einseitig von ihrem dbgl. Recht Gebrauch machend, die
Maislinie NK603 (herbizidresist) zum Import für Futtermittelzwecke (und im
November 2004 auch für Lebensmittelzwecke) zuließ, nachdem am Rat auch dafür
keine Mehrheit erzielt werden konnte.
Im Gegensatz
dazu bekräftigte das österreichische Parlament in einer von allen Parteien unterstützten
Entschließung im Juni 2004 neuerlich seine Aufforderung an die zuständigen Mitglieder
der Bundesregierung auf EU-Ebene weiterhin gegen die Neuzulassung von GVO einzutreten.
Am 13. Oktober
2004 verabschiedete das österreichische Parlament nach längerer Diskussion
schließlich die Novelle des Gentechnikgesetzes zur Umsetzung der
Freisetzungsrichtlinie. Ein Diskussionspunkt dabei war auch die Debatte um das
Problem des Nebeneinanderbestehens (Koexistenz) eines allfälligen
GVO-Pflanzenanbaus mit „gentechnikfreien“ Bewirtschaftungsformen, wie insb. dem
biologischen Landbau. Diese Diskussion führte letztlich zur Einführung neuer
nachbarrechtlicher Haftungsbestimmungen zum Schutz des GVO-freien Landbaus vor
unbeabsichtigten Verunreinigungen. Weitere Regelungen zur „Koexistenz“ sind in
diesem Bundesgesetz im Hinblick auf die mangelnde Bundeskompetenz nicht
enthalten. Auch aus diesem Grund begannen die Bundesländer – ausgehend von
einer Initiative des Landes Kärntens zur Regelung des Koexistenzproblems eigene
„Gentechnikvorsorgegesetze“ zu erarbeiten, mit denen der Anbau gentechnisch
veränderter Pflanzen einem landesrechtlichen Anmelde- oder
Bewilligungsverfahren unterzogen werden soll.
3.2.3. Koexistenz-Maßnahmen
Im Hinblick auf die Koexistenz hat
die Europäische Kommission (EK) im Jahr 2003 Leitlinien für nationale Maßnahmen
beschlossen. In ihrer Information vom 28.1.2004 betont die EK, dass alle
nationalen Maßnahmen betreffend Koexistenz als technische Vorschriften der EK
zu notifizieren sind. De facto Verbote für den Anbau von GVOs in Form von
gesetzlich festgelegten „Gentechnik-freien Gebieten“ seien nach Ansicht der EK
nicht EU-Rechts-konform.
Österreich setzt sich auf den Landwirtschaftsministerräten
nach wie vor für EU-weit harmonisierte Koexistenz-Regelungen ein. Insbesondere
die Frage der Haftung im Zusammenhang mit GVO-Verunreinigungen müsste aus
österreichischer Sicht auch auf
EU-Ebene geregelt werden.
Dennoch wird parallel dazu an einer
Österreichischen Koexistenz-Strategie gearbeitet. Laut Beschluss der
Landesagrarreferentenkonferenz vom März 2003 wurde im BMLFUW eine Arbeitsgruppe
„Gentechnik“ eingerichtet. Eine von dieser Arbeitsgruppe eingesetzte
Koexistenz-Strategiegruppe hat bereits einen Endbericht erstellt und der Konferenz
der LARK am 12.März 2004 Empfehlungen für eine gemeinsame Koexistenzstrategie
von Bund und Ländern vorgelegt.
Auf Basis der vorliegenden
Empfehlungen erarbeiten die Bundesländer - ausgehend vom „Kärntner Modell“ -
sog. Gentechnik-Vorsorgegesetze. Diese sehen prinzipiell vor, dass jeder
Landwirt, der GVOs anbauen will, einem behördlichen Verfahren unterliegt
(Anmelde- oder Bewilligungsverfahren). Im Rahmen des behördlichen Verfahrens
kann die Behörde Auflagen für den Anbau erteilen oder diesen verbieten. Die
benachbarten Landwirte sind in das Verfahren eingebunden. Jeder bewilligte
Anbau wird registriert
Bundeseinheitliche Richtlinien des
Koexistenzmanagements werden derzeit im Auftrag des BMLFUW in einer in der AGES
eingerichteten Expertengruppe ausgearbeitet. Sie sollen den Landesbehörden als
Entscheidungsgrundlage dienen, ob der GVO-Anbau im gegebenen Fall möglich ist
bzw. unter welchen Bedingungen (behördliche Auflagen, wie z.B. Isolationsabstände
zu GVO-freien Kulturen) der Anbau zugelassen werden kann.
3.3.
Genanalysen und Gentherapien am Menschen
3.3.1.
Genanalysen
Die
Durchführung von Genanalysen im Sinne des § 65 Abs. 1 Z 1 GTG darf nur in
hierfür zugelassenen Einrichtungen erfolgen (§ 68 GTG).
Der
wissenschaftliche Ausschuss für Genanalysen und Gentherapie am Menschen
erstellte gemäß § 68 Abs. 3 GTG in Verbindung mit § 88 GTG Gutachten zu
insgesamt 20 Anträgen auf Zulassung von Einrichtungen zur Durchführung von
Genanalysenrichtungen. Davon waren 11 Neuanträge, die übrigen 9 Anträge auf
Erweiterung einer bereits bestehenden Zulassung.
Nach Klärung
offener Punkte und Nachreichung ergänzender Informationen wurden alle 20 Einrichtungen
mit Bescheid zugelassen bzw. die Erweiterung der Tätigkeitsbereiche genehmigt.
Die bisher gut bewährte Praxis, den Antragstellern im Rahmen einer Sitzungen
des wissenschaftlichen Ausschusses für Genanalyse und Gentherapie die
Möglichkeit zu geben, allfällige offene Fragen zu ihrem Antrag persönlich zu
beantworten, wurde auch in diesem Berichtszeitraum fortgeführt.
Als Grundlage für die
Beurteilung der Anträge durch den zuständigen wissenschaftlichen Ausschuss
diente auch in diesem Berichtszeitraum der vom Ausschuss hierfür erarbeitete
und 1998 im Gentechnikbuch veröffentlichte ”Kriterienkatalog für die Anforderung
an Veranlassung und Durchführung einer Genanalyse im Sinne des § 65 Abs. 1 Z 1
GTG und an eine Einrichtung gemäß § 68 GTG”.
Die fachlichen
Erörterungen im Rahmen der Begutachtung bezogen sich vor allem auf Aspekte der
technischen Durchführung der Untersuchungen, auf die fachliche Qualifikation
und Erfahrung der verantwortlichen Laborleiter, auf die Handhabung der
Befundergebnisse, die Aufklärung und Beratung der untersuchten Personen, die
Maßnahmen zum Datenschutz sowie die Gewährleistung einer adaequaten externen
Qualitätssicherung durch die verpflichtende regelmäßige Teilnahme an
Ringversuchen.
Die zur Zulassung für die
Durchführung von Genanalysen im Sinne des § 65 Abs. 1 Z 1 beantragten
Einrichtungen sind auch in diesem Berichtszeitraum einerseits Einrichtungen mit
weitreichendem Tätigkeitsgebiet, in denen humangenetische Untersuchungen einer
Vielzahl genetisch determinierter Erkrankungen durchgeführt werden,
andererseits Einrichtungen mit eingeschränktem Tätigkeitsbereich, die
molekularbiologische Untersuchungen im Bereich eines speziellen medizinischen
Fachgebietes wie z.B. der Kinder- und Jugendheilkunde, der Dermatologie, der
medizinisch-chemischen Labordiagnostik und der internen Medizin durchführen.
Wie aus den angeführten
Zahlen hervorgeht, zeichnete sich im Berichtszeitraum eine Zunahme der
sogenannten „Erweiterungsänträge“ ab. Das bedeutet, dass Einrichtungen, die
bereits eine Zulassung gemäß § 68 GTG besitzen, nunmehr verstärkt ihr
Untersuchungsgebiet erweitern und ein größeres Spektrum an Untersuchungen
anbieten können und wollen. Dies resultiert gleichermaßen aus der zunehmenden
Praxis und Erfahrung der Einrichtungen bei der Durchführung von Gendiagnostik
als auch aus einer verstärkten Nachfrage der Patienten nach diesen neuartigen
Untersuchungsmethoden.
Die Zahl der 20
zugelassenen bzw. erweiterten
Einrichtungen setzt sich wie folgt zusammen:
8 Abteilungen von
Krankenanstalten der Länder oder Gemeinden
7 Universitätskliniken der
Medizinischen Universität Wien
2 Universitätsinstitute
(Wien und Graz)
3 private Einrichtungen
(alle in Wien)
3.3.2.
Gentherapien
Eine somatische Gentherapie an Menschen darf nur von einem
Arzt in einer hierfür gemäß § 75 Abs. 3 GTG zugelassenen Krankenanstalt
durchgeführt werden.
Im Berichtszeitraum wurde
kein Antrag auf Genehmigung zur Durchführung einer somatischen Gentherapie am
Menschen im Rahmen einer klinischen Prüfung gestellt.
Ebenso erfolgte keine
Antragstellung für eine Krankenanstalt gemäß § 75 Abs. 2 GTG.
4. Entwicklungen auf
EU-Ebene (Exkurs)
4.1. Arbeiten mit GVO in
geschlossenen Systemen
Die auf EU-Ebene für
Arbeiten mit GVO im geschlossenen System maßgebliche Richtlinie 90/291/EWG
wurde mit der RL 98/81/EG an den technischen Fortschritt angepasst. Die Umsetzung
dieser Änderungsrichtlinie erfolgte schließlich durch das Bundesgesetz zur
Änderung des Gentechnikgesetzes BGBl. I Nr. 94/2002 und durch die Erlassung der
Systemverordnung 2002, BGBl. II Nr. 431/2002.
4.2. Freisetzungen und
Inverkehrbringen von GVO
Die neue
Freisetzungsrichtlinie 2001/18/EG, mit der die alte Richtlinie 90/220/EWG
aufgehoben wurde, hätte bis 17. Oktober 2002 von den Mitgliedstaaten umgesetzt
werden sollen. Dieser Termin wurde von einer Mehrzahl der Mitgliedstaaten u.a.
auch deshalb nicht eingehalten, weil man auch die Erlassung der weiteren von
der EU angekündigten Verordnungen über gentechnisch veränderte Lebens- und
Futtermittel und über die Rückverfolgbarkeit von GVO und deren Kennzeichnung
aber auch weitere Durchführungsvorschriften zur RL 2001/18/EG selbst abwarten
wollte.
Eine weitere Novelle zum
Gentechnikgesetz, die diese Richtlinie nunmehr auch für Österreich umsetzt,
wurde nach längeren Vorarbeiten schließlich am 23. Oktober 2004 vom Nationalrat
verabschiedet. Mit dieser Novelle wurden auch zusätzliche Haftungsbestimmungen
zum Schutz der biologischen und gentechnikfreien Landwirtschaft beschlossen.
Die wesentlichen Inhalte
der RL 2001/18/EG können wie folgt zusammengefasst werden:
1.
Berücksichtigung
des Vorsorgeprinzips
2.
Erstmalige
Festlegung von einheitlichen Kriterien für die Risikobewertung unter besonderer
Berücksichtung auch langfristiger und akkumulierter Umweltauswirkungen
3.
Befristung
der Zulassung zum Inverkehrbringen auf längstens 10 Jahre
4.
Überprüfung
bestehender Zulassungen zum Inverkehrbringen
5.
eindeutige
Kennzeichnung und Maßnahmen zur Gewährleistung der Rückverfolgbarkeit
6.
Verpflichtende
Überwachung (Monitoring) von in Verkehr gebrachten Produkten
7.
Registerführung
über die Orte der Freisetzung und des kommerziellen Anbaus von GVO-Pflanzen zur
Erleichterung der Überwachung
8.
Festlegung
spezifischer Anwendungsbestimmungen in der schriftlichen Zustimmung, insbesondere
auch unter Berücksichtigung gegebener ökologischer Bedingungen
9.
schrittweise
Einstellung der Verwendung von bedenklichen Antibiotika-Resistenz-Markern in
GVO-Produkten bis 31.12.2004 (für Freisetzungen zu Forschungszwecken bis Ende
2008)
10.
verbesserte
Transparenz und Öffentlichkeitsbeteiligung
11.
Berichtspflichten
der Kommission, so z.B. auch über die sozioökonomischen Auswirkungen von
Freisetzungen und Inverkehrbringen von GVO
12.
Verpflichtung
zur künftigen Übernahme der Bestimmungen des Cartagena-Protokolles über die
biologische Sicherheit betreffend das Verfahren der vorherigen Zustimmung bei Exporten.
4.3. Gentechnisch
veränderte Lebens- und Futtermittel
In den Berichtszeitraum
fällt auch die Erlassung der EU Verordnungen (EG) 1829/2003 und (EG) 1830/2003,
mit denen ein neues umfassendes Zulassungsverfahren für alle Lebens- und Futtermittel,
die aus GVO hergestellt werden, sowie eine strenge Kennzeichnungspflicht und
Rückverfolgbarkeitsanforderungen festgelegt wurden. Neue Zulassungsanträge für
GVO, die ausschließlich für die Herstellung von Lebens- oder Futtermitteln
verwendet werden, werden somit in Zukunft nicht mehr über die Verfahren gemäß
der Freisetzungsrichtlinie 2001/18/EG, sondern gemäß dem hauptsächlich bei der
EFSA (Europäische Behörde für Lebensmittelsicherheit) und der EU-Kommission
konzentrierten Verfahren abgewickelt werden.
5.
Bewertung der beobachteten Entwicklungen, Konsequenzen
5.1.
Grundsätze des Gentechnikgesetzes
Die
Gentechnikkommission hat dem gesetzlichen Auftrag entsprechend die beobachteten
Entwicklungen im Hinblick auf die Beachtung folgender Grundsätze zu bewerten,
die bei der Vollziehung dieses Bundesgesetzes zu beachten sind:
5.1.1.
Vorsorgeprinzip
„Arbeiten
mit GVO und Freisetzungen von GVO in die Umwelt sind nur zulässig, wenn dadurch
nach dem Stand von Wissenschaft und Technik keine nachteiligen Folgen für die
Sicherheit zu erwarten sind (§ 3 Z 1 GTG)“.
Bei
Arbeiten mit GVO im geschlossenen System wird diesem Prinzip auf mehrfache
Weise Rechnung getragen: zum einen ist der Betreiber einer gentechnischen
Anlage von Gesetz wegen angehalten, durch die Bestellung eines entsprechend
qualifizierten Beauftragten für die biologische Sicherheit, seines
Stellvertreters und des Komitees für die biologische Sicherheit die Sicherheit
bei der Arbeit mit GVO sicherzustellen. Bei Ausscheiden dieser Personen aus
ihrer Funktion ist eine Neubestellung vorzunehmen; jeder Wechsel ist der
Behörde bekannt zu geben, die ihrerseits zu prüfen hat, ob auch hier die
notwendige Qualifikation der Personen nachgewiesen werden kann.
Zwingend
vorgesehen ist auch die Bekanntgabe des Beauftragten für die biologische
Sicherheit und seines Stellvertreters an die örtliche Feuerwehr.
Ein
weiteres Kriterium ist die gesetzlich normierte Einbindung des zuständigen wissenschaftlichen
Ausschusses der Gentechnikkommission für jene in § 22 Abs. 3 GTG genannten
Arbeiten mit GVO im geschlossenen System.
Von
Seiten der Behörde ist die Überprüfung der Einhaltung der notwendigen
Sicherheitsmaßnahmen durch die Befugnis zur Durchführung von Kontrollen
geregelt (§ 101 GTG). Derartige Kontrollen, die im Berichtszeitraum erfolgten,
ergaben keine Beanstandungen. Desgleichen wurden keinerlei Unfälle bei Arbeiten
mit GVO gemeldet.
Die
im zweiten Bericht der Gentechnikkommission an den Nationalrat beschriebene
Initiative „European Enforcement Project of EU Directive 90/219“ hat sich im
Laufe der letzten drei Jahre dahingehend weiterentwickelt, als sie auch auf den
Bereich „Freisetzung und Inverkehrbringen von GVOs“ – anfangs auch mit finanzieller
Unterstützung der Europäischen Kommission – ausgedehnt wurde. Die Aktivitäten
dieser Gruppe „European Enforcement Project on Contained Use and Deliberate
Release of GMOs“ erstrecken sich u.a. auf die Durchführung von Risk
Assessment-Workshops im Rahmen ihrer jährlichen Treffen und die Ausarbeitung
von Monitoringplänen und Checklisten zur Inspektion (Contained Use and
Deliberate Release), welche nicht nur von Bedeutung für die Tätigkeit der
Inspektoren ist, sondern auch beispielsweise in die Arbeiten der
Monitoring-Arbeitsgruppe, welche unter dem Ausschuss der zuständigen Behörden
zur Durchführung der RL 2001/18/EG eingerichtet wurde, einfließt. Weiters organisieren
die Mitglieder des „European Enforcement Projects“ „Joint Inspections“, wodurch
die Effektivität der Kontrollen in organisatorischer und technischer Hinsicht
optimiert werden konnte.
Im
Jahr 2004 hat auch das Bundesministerium für Gesundheit und Frauen eine „Joint
Inspektion“ von Arbeiten in der Sicherheitsstufe 2 (kleiner Maßstab) im
geschlossenen System mit Vertretern aus der Schweiz, Norwegen, Finnland,
Niederlande und Slowenien durchgeführt.
Ein
weiteres wichtiges Anliegen dieser Gruppe stellt die Integration der neuen
Mitgliedstaaten in die Aktivitäten des „European Enforcement Projects“ dar.
Für
Freisetzungen und Inverkehrbringen von GVO wurde das Vorsorgeprinzip in der
EU-Richtlinie 2001/18/EG sowie auch im Cartagena Protokoll über die Biologische
Sicherheit und in der dazu ergangenen EU Durchführungsverordnung explizit verankert.
Für eine entsprechende Umsetzung ist die detaillierte Erarbeitung von Kriterien
für die Risikoabschätzung und –bewertung
- unter Einbeziehung aller gesundheitlichen und ökologischen Aspekte –
notwendig. Dabei sind auch ethische Aspekte zu berücksichtigen, ebenso die
Frage, wie mit wissenschaftlicher
Unsicherheit („Uncertainty“) im Zuge der Risikoabschätzung und besonders im Zusammenhang
mit dem Kriterium der Persistenz bestimmter GVO umzugehen ist.
5.1.2. Zukunftsprinzip
„Der Forschung auf dem Gebiet
der Gentechnik und der Umsetzung ihrer Ergebnisse sind unter Beachtung der
Sicherheit keine unangemessenen Beschränkungen aufzuerlegen“
(§ 3 Z 2 GTG).
Hier ist zunächst auf den
Punkt 5.4. Sicherheitsforschung zur Gentechnik zu verweisen, der Art und Umfang
der vergebenen Forschungsaufträge im Berichtszeitraum darstellt.
Festzuhalten ist, dass das
Zukunftsprinzip in engem Zusammenhang mit dem Vorsorgeprinzip zu sehen ist und
keinen Widerspruch hiezu darstellt: Effektive Forschung im Bereich der Sicherheit
der Anwendung von GVO kann gewährleisten, dass mögliche Risken und Gefahren erkannt,
evaluiert und in ihren mittel- und langfristigen Konsequenzen für Mensch und
Umwelt erfasst werden können; eine Beschränkung auf diesem Gebiet würde daher
nicht nur einen Rückschritt in der Qualitätssicherung gentechnischer
Anwendungen bedeuten, sondern auch
den Weg zu internationaler wissenschaftlicher Kommunikation versperren und
derart verhindert, die positiven Entwicklungen auf dem Gebiet der
Biotechnologie mitzuverfolgen und für die Allgemeinheit nutzbar zu machen.
Die Gen- und
Biotechnologie stellt gemäß dem Regierungsübereinkommen 2000 (Kapitel neuer
sozialer Gesellschaftsvertrag sowie
Bildung und Sport, Wissenschaft und Forschung) neben anderen
Fachgebieten einen wesentlichen Forschungs- und Entwicklungsschwerpunkt dar.
Der
europäische Rat in Göteborg im Juni 2001 hat die Gen –und Biotechnologie
gemeinsam mit den Informationstechnologien als eine der Schlüsseltechnologien
des 21. Jahrhunderts identifiziert.
Die
biotechnologische Forschung mit gentechnischen Methoden und ihre
wirtschaftliche Anwendung ist in vielen Bereichen in Österreich gut entwickelt
und genießt international Anerkennung. Auch die Anwendung neuester
Forschungsergebnisse auf dem Gebiet der Medizin und die Entwicklung neuer
Arzneimittel wird in Österreich von einer breiten Öffentlichkeit akzeptiert.
Aus Sicht der Forschung auf dem Gebiet der Gentechnik stellt die pauschale
Ablehnung von Freisetzungen von gentechnisch veränderten Organismen zu
Forschungszwecken eine Beeinträchtigung des Zukunftsprinzips dar. Die durch die
Novelle des GTG im Jahr 2004 (Umsetzung der Freisetzungsrichtlinie 2001/18/EG)
geschaffenen klaren Kriterien für die Risikoabschätzung, die neuen Haftungsbestimmungen
sowie eine neutrale und sachgerechte Information der Öffentlichkeit sollten
einen Beitrag zu einem differenzierten Meinungsbildungsprozess leisten.
5.1.3. Stufenprinzip
„Die Freisetzung von GVO
darf nur stufenweise erfolgen, indem die Einschließung der GVO stufenweise
gelockert und deren Freisetzung nur ausgeweitet werden darf, wenn die Bewertung
der vorhergegangenen Stufe ergibt, dass die nachfolgende Stufe mit dem
Vorsorgeprinzip vereinbar erscheint“ (§ 3 Z 3 GTG).
Zu diesem Prinzip können
gegenwärtig keine konkreten für Österreich spezifischen Aussagen getroffen
werden, da im Berichtszeitraum in Österreich kein Antrag auf Genehmigung zur
Freisetzung von gentechnisch veränderten Organismen eingebracht wurde.
5.1.4. Demokratisches Prinzip
Die Öffentlichkeit ist
nach Maßgabe dieses Bundesgesetzes in die Vollziehung einzubinden, um deren
Information und Mitwirkung sicherzustellen (§ 3 Z 4 GTG).
Durch die (im Oktober
2004) beschlossene Gentechnikgesetznovelle zur Umsetzung der Freisetzungsrichtlinie
2001/18/EG wurden im Sinne einer verstärkten Transparenz weitere Informationspflichten
zugunsten der Öffentlichkeit im Hinblick auf Freisetzungs- und Inverkehrbringensanträge
festgelegt.
Da auch in
diesem Berichtszeitraum weder Anträge auf Genehmigung zur Freisetzung von
gentechnisch veränderten Organismen, noch Anträge zur Durchführung von Arbeiten
mit gentechnisch veränderten Organismen in geschlossenen Systemen in höheren
Sicherheitsstufen und großem Maßstab gestellt wurden, fanden keine
Anhörungsverfahren im Sinne der §§ 28 und 43 GTG statt.
Dennoch
war ein gleichbleibendes Interesse der Bevölkerung an Informationen über
allgemeine und spezielle Themen der Gentechnik und Biotechnologie zu
verzeichnen, was sich an zahlreichen telefonischen und schriftlichen Anfragen
sowie auch E-mail-Eingaben zeigte. Bewährt hat sich hier weiterhin der Hinweis
auf die seit 1997 eingerichtete Internet-Homepage des Bundesministeriums für
Gesundheit und Frauen mit der Adresse http://www.gentechnik.gv.at.
Diese Homepage wurde im Frühsommer 2004 grundlegend überarbeitet und neu
gestaltet, das Layout wurde dem Corporate Design des Ressorts angepasst und die
Seite auch in dessen Homepage www.bmgf.gv.at
integriert.
Verstärkt
genutzt wurde von Biotechnologie-Firmen und Genanalyse-Einrichtungen die Möglichkeit
des Herunterladens von Antrags- und Anmeldeformularen sowie
Informationsblättern und Gesetzes- bzw. Verordnungstexten. Dies erleichtert es
den Antragstellern, sich bereits vor Einreichung eines Antrages oder einer
Anmeldung ausreichend über alle Erfordernisse dieser Verwaltungsverfahren zu
informieren. Fehlerhafte oder unschlüssige Anbringen haben sich dadurch
deutlich reduziert. Der Kontakt zwischen Behörde und Bürger wird sichtlich
verbessert, wenn erforderliche Informationen möglichst übersichtlich, aktuell
und in leicht zugänglicher Weise angeboten werden.
Ebenfalls
seit 1995 besteht die Homepage des Bundesministeriums für Bildung, Wissenschaft
und Kultur mit der Adresse http://www.bmbwk.gv.at/gentechnik.
5.1.5. Ethisches Prinzip
„Bei Genanalysen und
Gentherapien am Menschen ist auf die Wahrung der Menschenwürde Bedacht zu
nehmen; der Verantwortung des Menschen für Tier, Pflanze und Ökosystem ist
Rechnung zu tragen“ (§ 3 Z 5 GTG).
a) Im Berichtszeitraum
konnte, wie schon in den Jahren zuvor, eine Tendenz zur verstärkten Diskussion
ethischer Aspekte der Gentechnik beobachtet werden. Der rasche wissenschaftliche
und technische Fortschritt auf dem Gebiet der Biotechnologie im allgemeinen und
bei der Anwendung gentechnische Methoden in der Humanmedizin im besonderen
führt in interdisziplinär besetzten Gremien zwangsläufig zur eingehenden
Beschäftigung mit der Frage, wie – im Zuge immer größerer technischer
Machbarkeit biotechnologischer Aktivitäten - den individuellen Rechten, Interessen und Bedürfnissen des
Einzelnen im Lichte dieser Entwicklungen bestmöglich Rechnung getragen werden
kann.
Diesen Fragen haben sich
in letzter Zeit verstärkt auch alle einschlägig zuständigen internationalen
Organisationen, insbesondere Europarat, OECD, UNESCO und, im Rahmen ihrer
rechtlichen Möglichkeiten, auch die Europäische Union, gewidmet.
Der zuständige
wissenschaftliche Ausschuss bzw. die daraus hervorgegangene Arbeitsgruppe
„Gentechnik und Medizin“ haben sich – durchaus unter Berücksichtigung dieser
internationalen Diskussionen - eingehend mit den neuen Entwicklungen
beschäftigt. Schwerpunkte der Diskussion waren vor allem Fragen der
Patientenberatung und des Umganges mit personenbezogenen, sensiblen Daten im
Zeitalter globaler Forschung (Stichwort: Biobanken) sowie die Frage der
rechtlichen und ethischen Zulässigkeit der Präimplantationsdiagnostik (PID).
Während der Umgang mit
Biobanken im wesentlichen nur im Gleichklang mit internationalen Richtlinien
gelöst werden kann, welche ihrerseits auf einem globalen ethischen und
rechtlichen Konsens beruhen, hat sich die o.a. Arbeitsgruppe für eine
ausdrückliche nationale Regelung der PID ausgesprochen und nach intensiver
Diskussion ethischer, technischer und rechtlicher Aspekte die ausdrückliche
rechtliche Zulässigkeit der PID in Österreich einstimmig empfohlen.
PID ist eine
molekulargenetische Untersuchung von Embryonen, welche im Reagenzglas erzeugt
und vor der Einpflanzung in die Gebärmutter auf (bestimmte, dzt. ca. 40)
Erbkrankheiten (Chromosomen- oder Gendefekte) untersucht werden.
Wegen der
methodenbedingten Unsicherheiten und Interpretationsschwierigkeiten wird nach
der Implantation eines gemäß PID als gesund eingestuften Embryos noch eine
Überprüfung durch gängige (und auch in Österreich bereits erlaubte)
pränataldiagnostische Methoden durchgeführt. Nach Auffassung der Arbeitsgruppe
ist PID eine alternative Methode zu (Spät-)Abtreibungen wie auch zur
freiwilligen Kinderlosigkeit sog. „Hochrisikopaare“ und insofern eine grundsätzlich
auf Leben bzw. Lebenserhaltung hin angewandte, und daher ethisch vertretbare,
Methode.
Die PID ist nach
herrschender Rechtsmeinung in Österreich derzeit verboten. Österreich befindet
sich mit diesem Verbot gemeinsam mit Deutschland, der Schweiz, Irland und
Italien in einer klaren Minderheitsposition. In allen anderen europäischen
Staaten ist PID implizit oder explizit rechtlich erlaubt und wird auch
tatsächlich praktiziert
Die von der Arbeitsgruppe
angestrebte Zulassung sollte rechtssystematisch korrekterweise im
Gentechnikgesetz erfolgen, welches bereits jetzt bestimmte, pränatale
Untersuchungen regelt.
Grundsätzlich sollte die
PID jedoch nicht generell zulässig sein, sondern nur bei Vorliegen folgender
Kriterien:
·
hohes
Risiko für das Auftreten einer bestimmten schwerwiegenden, genetischen Krankheit
bei den Nachkommen des Paares
·
diese
Krankheit äußert sich durch schwere körperliche oder geistige Fehlbildung und
·
ist
nach dem Stand der Wissenschaft nicht behandelbar
Unter der Voraussetzung
dieses eingeschränkten Zuganges zur PID handelt es sich dabei in Österreich um
10 bis 20 betroffene Paare pro Jahr.
Auch die
Bioethikkommission des Bundeskanzlers (BEK) hat am 7. Juli 2004 ihre Empfehlungen
betreffend den Umgang mit PID verabschiedet. Die BEK hat sich dabei
mehrheitlich ebenfalls für eine ethische Zulässigkeit der PID in bestimmten,
eng umschriebenen Anwendungsfällen ausgesprochen. Genannt wurden dabei 1.
rezidivierend fehlschlagende IVF/ICSI, 2. Fälle, in denen aufgrund von chromosomalen
oder genetischen Befunden das Risiko einer schweren Erkrankung besteht, welche
entweder noch während der Schwangerschaft, bei der Geburt oder bis spätestens
wenige Monate nach der Geburt zum Tode führt und die sich zuverlässig
diagnostizieren, jedoch nicht medizinisch behandeln lässt, sowie 3. jene Fälle,
wo Paare ein hohes Risiko aufweisen, ein Kind mit schwerer genetisch bedingter
Erkrankung zu bekommen, welche bei bereits vorliegender Schwangerschaft als
medizinische Indikation für die PND gelten würde. In diesen Fällen wird
empfohlen, auch die Bestimmung des Geschlechts mit Krankheitsbezug zuzulassen.
Darüber hinaus sollten administrative Rahmenbedingungen eine entsprechende
Qualitätskontrolle, z.B. in Form einer Zulassungspflicht der befugten
medizinischen Einrichtungen auf der Grundlage materieller
Qualifikationsanforderungen sicherstellen.
Die genannten Empfehlungen
stimmen weitgehend mit den Diskussionsergebnissen der ho. Arbeitsgruppe zur
Novellierung des Gentechnikgesetzes (medizinischer Teil) überein; sie sollen
auch nach Wunsch der BEK in die derzeit in Ausarbeitung befindliche Novelle des
GTG betreffend Genanalyse und Gentherapie am Menschen eingebaut werden.
(Anmerkung: Die
Stellungnahme der Bioethikkommission sowie die zur PID vertretenen Minderheitenpositionen,
die z.T. auch für eine Beibehaltung der bisherigen Gesetzeslage einsetzen, sind
im Internet unter www.bka.gv.at/bioethik/
abrufbar. In der Gentechnikkommission wurde die Frage der PID bisher nicht
diskutiert.)
b) Die Beachtung des
ethischen Prinzips in der Verantwortung des Menschen für Tier, Pflanze und
Ökosystem ist insbesondere durch die Berücksichtigung langfristiger und
indirekter Auswirkungen gentechnischer Anwendungen auf die Umwelt zu
gewährleisten.
5.2. Bildungs- und
forschungspolitische Konsequenzen
Ein Blick in die
Tageszeitungen des Landes zeigt, dass Berichterstattung über Biotechnologie zu
einem festen Bestandteil der Medienlandschaft und des täglichen Informationsangebotes
von Presse, Hörfunk und Fernsehen sowie dem Internet geworden ist.
Über die Erfolge bei der
Sequenzierung des menschlichen Genoms wurde in den Medien ausführlich
berichtet. Ebenso schreitet die Sequenzierung von Genomen von für die Forschung
wichtigen Tier- und Pflanzenmodellen, aber auch von Mikroorganismen rasant
fort. Der Sequenzierung und Entschlüsselung der Gene folgen nunmehr weitere
wichtige Bereiche der Genom- und Biotechnologieforschung, wie die Erforschung
der Funktionen der Gene (Functional Genomics) sowie die Erforschung der
Wirkungsweise der von den Genen gebildeten Proteine (Proteomics) und ihrer
Metaboliten (Metabolomics).
Die Belange der Gentechnik
und Biotechnologie haben in den letzten Jahren alle Bereiche des Lebens entscheidend
geprägt und verändert: beginnend bei der Landwirtschaft und der Lebensmittelproduktion über den
Einsatz der Gentechnik bei der Herstellung von Medikamenten, Impfstoffen und
Medizinprodukten bis hin zu den modernsten Methoden der genetischen Analytik,
der somatischen Gentherapie und den neuesten Entwicklungen auf dem Gebiet der
Fortpflanzungsmedizin und der Stammzellenforschung sind ungemein viele und
komplex miteinander vernetzte Bereiche von den neuartigen Technologien erfasst.
Sachwissen
über Gentechnik wird in Zukunft weiter an Bedeutung gewinnen. Diese Aufgabe
kann und soll nicht den Forschenden allein überlassen werden. Entsprechend den
unterschiedlichen Anwendungsgebieten ist ein konstruktives Zusammenwirken von
Schulen, Universitäten, Landwirtschaft, Handel, Industrie, Arbeitnehmer-,
Konsumenten – und Umweltgruppen bis hin zu den Gesundheitsberufen erforderlich.
Auch in diesem
Berichtszeitraum fanden in zahlreichen öffentlichen und privaten Institutionen
Veranstaltungen statt, die dem
Thema Gentechnik gewidmet waren. Projekte in Schulen, Vortragstätigkeiten,
Podiumsdiskussionen, die Bereitstellung umfangreichen Informationsmaterials
sowie nicht unwesentlich auch Kongresse und Symposien auf nationaler und
internationaler Ebene konnten hier in bildungspolitischer Hinsicht wertvolle
Beiträge leisten. Der Verantwortung
der Wissenschafter in diesem Bereich wird insbesondere durch den Verein Dialog<>Gentechnik
Rechnung getragen (Homepage: http://www.dialog-gentechnik.at).
Bemühungen in diesem
Bereich werden fortgesetzt, um den so wichtigen Dialog zwischen der
Wissenschaft, der Wirtschaft, der Industrie, den Interessenvertretungen und der
Öffentlichkeit in Gang zu halten und dessen Ergebnisse und Erkenntnisse nutzbar
für weitere Entwicklungen zu machen.
5.3. Das Österreichische
Genomforschungsprogramm „GEN-AU“
Das Bundesministerium für
Bildung, Wissenschaft und Kultur hat im September 2001 ein österreichisches
Genomforschungsprogramm („GEN-AU“) ausgeschrieben.
Dieses Programm soll einen
wichtigen Beitrag zur Umsetzung des Regierungsübereinkommens leisten
("Bio- und Gentechnologie stellen neben anderen Fachgebieten einen
wesentlichen Forschungs- und Entwicklungsschwerpunkt dar") sowie des
Beschlusses der Bundesregierung zur Forschungs- und Technologiepolitik, in dem
ausgeführt wird : "In den Jahren 2001/2002 sollten mit den
Finanzierungsmaßnahmen des Bundes abgedeckt werden: ... (c) die im Regierungsübereinkommen
festgelegten Vorhaben: "Vernetzung mit europäischen Partnern und
zielgerichteter Ausbau von Kompetenzclustern; Ausbau der Programmförderung
durch Einrichtung themenkonzentrierter nationaler Forschungsprogramme in
Abstimmung mit entsprechenden EU-Programmen, insbesondere der Bio- und
Gentechnologie."
Mit diesem
Forschungsprogramm soll die Zukunftsfähigkeit Österreichs auf dem zentralen
Feld der Biowissenschaften im 21. Jahrhundert gesichert werden, das zum einen
erhebliche Bedeutung für den Erkenntnisfortschritt in der Wissenschaft und zum
anderen für die Innovationsfähigkeit einer Vielzahl von Wirtschaftsbereichen
mit hoher Wertschöpfung hat.
Nur mit einem
eigenständigen nationalen Genomforschungsprogramm kann Österreich nachhaltig
seine internationale Wettbewerbsfähigkeit auf einem Forschungsgebiet sichern,
das weltweit in den nächsten Jahrzehnten die zentrale Leitwissenschaft
darstellt und deren Forschungsergebnisse und Umsetzung in innovative Produkte,
Technologien und Dienstleistungen von entscheidender Bedeutung sind.
Gleichzeitig schafft Österreich damit die Voraussetzungen, um sich in diesem
Bereich an führender Stelle im Europäischen Forschungsraum zu positionieren,
der mit neuen Initiativen im 6. EU-Forschungsrahmenprogramm gerade auf dem
Gebiet der Genomforschung vielfältige inhaltliche und strukturelle Impulse
erhalten wird. Mit diesem Programm werden die Voraussetzungen zu einer
Teilnahme an diesen Aktionen erst gelegt.
Die Ergebnisse der
Genomforschung werden zu einem neuen Bild und einem neuen Verständnis über
Ursachen und Abläufe von Lebensvorgängen verhelfen, zu einem besseren Verständnis der Ursachen menschlicher Erkrankungen
und zur Entwicklung neuer Medikamente und Therapien beitragen, welche die
Heilung bisher nicht oder nur schwer therapierbarer Krankheiten, wie Krebs,
Infektionskrankheiten oder neurologische Erkrankungen, ermöglichen. Aber auch
die Bekämpfung von Tier- und Pflanzenkrankheiten kann durch neue Erkenntnisse
aus der Genomforschung erhebliche Fortschritte machen, die nicht zuletzt einer
umweltgerechten und gesunden Landwirtschaft zugute kommen, die in Österreich
eine gute und lange Tradition hat. Die Biotechnologie und die chemische
Industrie werden von den Erkenntnissen der Genomforschung profitieren, indem
den Produktionsprozessen Energie sparende und Umwelt und Ressourcen schonende
biologische Prinzipien zu Grunde gelegt werden. Neue Pflanzen und
Mikroorganismen werden als Umweltsensoren eingesetzt und können gleichzeitig Umweltschäden
reparieren.
Diese und viele andere
Chancen für die Forschung und die Umsetzung der Forschungsergebnisse sollen
durch das österreichische Genomforschungsprogramm GEN-AU genutzt werden.
Darüber hinaus verspricht sich das Bundesministerium für Bildung, Wissenschaft
und Kultur von diesem Programm nachhaltige Hebelwirkungen für die nationale und
internationale Vernetzung der universitären und außeruniversitären
Forschungskapazitäten, für die Entwicklung von Kompetenzzentren der
Genomforschung, für die weitere Verbesserung der Aus- und Weiterbildung des
wissenschaftlichen Nachwuchses und insbesondere auch für die Intensivierung des
Technologietransfers und die Etablierung von Kooperationen zwischen der
akademischen Forschung und der Wirtschaft.
Großer Wert wird darauf
gelegt, die naturwissenschaftliche Forschung und auch die wirtschaftliche
Anwendung der Forschungsergebnisse durch geistes- und sozialwissenschaftliche
Forschung zu begleiten. Nur so können die ethischen, rechtlichen und sozialen
Fragen rechtzeitig erkannt und einer Lösung zugeführt werden, die sich aus dem
beschleunigten Erkenntnisgewinn vor allem in der Humangenomforschung und den
damit einhergehenden großen medizinischen Fortschritten und dem Umgang mit
medizinischer Information insgesamt ergeben.
Hierzu sind
Forschungsprojekte und ein offener Diskurs mit allen Akteuren - Öffentlichkeit,
Wissenschaft, Wirtschaft, Politik - erforderlich, die das Bundesministerium für
Bildung, Wissenschaft und Kultur im Rahmen einer gesonderten Ausschreibung
anregt und unterstützt.
Auf der Homepage des
Genomforschungsprogramms (www.gen-au.at)
werden ausführliche und laufend aktualisierte Informationen zur Verfügung
gestellt.
5.4. Wirtschaftliche
Konsequenzen
"Life
Sciences", ein Begriff, der sämtliche Bereiche der Gentechnik und
-technologie inkludiert, wird heute als Schlüsseltechnologie des 21.
Jahrhunderts mit enormem wirtschaftlichem Wachstumspotenzial betrachtet. Die
Europäische Kommission hat dies im Jahr 2002 mit der Herausgabe der europäischen
Strategie für Biotechnologie und Biowissenschaften dementsprechend betont. Das
Wechselspiel zwischen Grundlagenforschung und wirtschaftlicher Anwendung ist
gerade im Bereich der Gentechnik von besonderer Bedeutung. Um dies möglichst
friktionsfrei zu erhalten, ist ein gesellschaftliches Klima vonnöten, in den
eine informierte öffentliche Meinung der Forschung und den sich daraus
ergebenden Anwendungen positiv gegenübersteht. Allgemeine Rahmenbedingungen für
Innovation, Rechtssicherheit für Betriebe, das Vorhandensein adäquat
ausgebildeter Arbeitskräfte und ausreichende Infrastruktur in entsprechender
Qualität stellen weitere Grundvoraussetzungen für die Entwicklung und Anwendung
moderner Technologien dar.
Das
im Jahre 1999 ins Leben gerufene "Impulsprogramm Biotechnologie" wird
- nunmehr unter der Marke LISA - "Life Science Austria" - seit Herbst
2003 innerhalb der AWS (Austria Wirtschaftsservice) operational abgewickelt.
Zur Unterstützung bei Unternehmensgründungen und zur Förderung der
biotechnologischen Forschung in jungen Unternehmen wurde ein
"one-stop-shop" eingerichtet, der Jungunternehmern ein umfassendes
Service von der Beratung und Betreuung, über Finanzierung, Netzwerkaktivitäten
bis zur Aus- und Weiterbildung bietet.
Innerhalb
der 2004 neu gegründeten Forschungsförderungsgesellschaft (FFG) werden im Bereich
des ehemaligen FFF (Forschungsförderungsfonds für die gewerbliche Wirtschaft)
pro Jahr rund 30 Mio. € für Projekte biotechnologischer Ausrichtung in der
industriellen Forschung zur Verfügung gestellt. Mit dem Bereich des ehemaligen
BIT (Büro für internationale Technologiekooperation) existiert ein nationales
Service- und Informationszentrum für alle nationalen und internationalen
Forschungs- und Technologieprogramme, worin "Life Sciences" ein
wichtiger Stellenwert beigemessen wird.
Diese
Initiativen zeigen, dass umfassende Förderkonzepte notwendig sind, um
Österreich auch weiterhin als wirtschaftlichen Standort biotechnologischer
Aktivitäten zu erhalten und zu stabilisieren. In einigen Bereichen
biomedizinischer Forschung ist Österreich durchaus in der Lage, im europäischen
und globalen Wettbewerb zu bestehen. Gerade die jüngste Vergangenheit zeigt,
dass auch österreichische Unternehmen in der Lage sind, sich in diesem Wettbewerb
hervorragend zu positionieren.
5.5.
Sicherheitsforschung zur Gentechnik
5.5.1. im
Auftrag des Bundesministeriums für Gesundheit und Frauen (bzw. vormals des
Bundesministeriums für soziale Sicherheit und Generationen) wurden im Berichtszeitraum
folgende Forschungsaufträge vergeben:
·
Titel:
Monitoring von mit gentechnisch verändertem Mais kontaminierten Maisfeldern
Auftragnehmer: Umweltbundesamt Wien
Auftragsumme: € 135.352,--
·
Titel: GVO-freie Bewirtschaftungsgebiete: Konzeption und Analyse von
Szenarien und Umsetzungsschritten
Auftragnehmer: Dipl.-Ing. Werner Müller
Auftragsumme: € 13.954,--
·
Titel: Concepts of Coexistence
Auftragnehmer: Dipl.-Ing. Werner Müller
Auftragsumme: € 9.600,--
·
Titel: Evaluating Substantial Equivalence – A step towards improving the
risk/safety evaluation of GMOs
Auftragnehmer: Umweltbundesamt Wien und Interuniversitäres
Forschungszentrum für Technik, Arbeit und Kultur
Auftragsumme: € 6.541,--
·
Titel: Moratorium der Gentechnik? Verfassungs- und europarechtliche Vorgaben
der Errichtung gentechnikfreier Bewirtschaftungsgebiete
Auftragnehmer: Univ. Prof. Dr. Manfred Stelzer (Universität Wien)
Auftragsumme: € 23.760,--
·
Titel: Durchführung von Untersuchungen zu einem ökologischen Monitoring von
gentechnisch veränderten Organismen
Auftragnehmer: Umweltbundesamt Wien, Institut für Ökologie und
Naturschutz (Universität Wien)
Auftragsumme: € 115.682,--
·
Titel: Toxikologie und Allergologie von GVO-Produkten
Untersuchung zur Praxis und Empfehlungen zur Standardisierung der
Sicherheitsbewertung von gentechnisch veränderten Lebensmitteln (Teil I)
Untersuchung von Regelungen zur Sicherheitsbewertung von gentechnisch
veränderten Lebensmitteln in der EU und den USA (Teil II)
Auftragnehmer: Umweltbundesamt Wien und Interuniversitäres
Forschungszentrum für Technik, Arbeit und Kultur
Auftragsumme: € 21.802,-- (die Hauptfinanzierung erfolgte durch das Bundesministerium
für Wirtschaft und Arbeit)
·
Titel: Datenschutz im Gentechnikrecht
Studie über den allfälligen Anpassungsbedarf der datenschutzrechtlichen
Bestimmungen des Gentechnikgesetzes
Auftragnehmer: Univ.Prof. Dr. Manfred Stelzer (Universität Wien)
Auftragsumme: € 7.000,--
·
Titel: Agrarökologie von Reis und Baumwolle – Kurzstudie
Grundlagen zur Beurteilung der Grünen Gentechnik
Auftragnehmer: DI Helmut Reiner
Auftragsumme: € 2.940,--
·
Titel: Risk
Assessment of GMO Products in the European Union
Toxicity assessment, allergenicity assessment and substantial equivalence in
practice and proposals for improvement and standardisation
Auftragnehmer: Umweltbundesamt Wien und Interuniversitäres Forschungszentrum für Technik,
Arbeit und Kultur
Auftragsumme: € 22.040,--
·
Titel:
Fachgrundlagen für eine österreichische Position für die Risikoabschätzung von
gentechnisch veränderten Organismen (GVO) im Rahmen der RL 2001/18/EG –
Biodiversitäts-Hotspots der Agrarlandwirtschaft als Eckpfeiler für
Risikoabschätzung und Monitoring von GVO
Auftragnehmer: Umweltbundesamt Wien, Dr. Andreas Traxler
Auftragsumme: € 62.888,-- (unter Mitfinanzierung durch das
Bundesministerium für Land- und Forstwirtschaft, Umwelt und Wasserwirtschaft)
·
Titel:
Koexistenz von gentechnisch veränderten, konventionellen und biologisch angebauten
Kulturpflanzen in der österreichischen Landwirtschaft – Handlungsempfehlungen
aus ökologischer Sicht
Auftragnehmer: Dr. Kathrin Pascher, Mag. Marion Dolezel (Institut für
Ökologie und Naturschutz, Universität Wien)
Auftragsumme: € 45.000,--
·
Titel: Gutachten
zum Dokument der Europäischen Behörde für Lebensmittelsicherheit – Draft
Guidance Document for the Risk Assessment of Genetically Modified Plants and
Derived Food and Feed
Auftragnehmer: Umweltbundesamt Wien und Interuniversitäres Forschungszentrum für Technik,
Arbeit und Kultur
Auftragsumme: € 6.724,--
Soweit zu den
o.a. genannten Forschungsaufträgen bereits Forschungsberichte vorliegen können
diese vom Bundesministerium für Gesundheit und Frauen - Sektion IV – (online Bestellservice
des Bundesministerium für Gesundheit und Frauen: http://www.gentechnik.gv.at)
bezogen werden.
5.5.2. im
Auftrag des Bundesministeriums für Bildung, Wissenschaft und Kultur:
·
"Begleitkommission Transgene Obstbäume"
(Begleitkommission und
Expertengutachten zum Projekt ´Charakterisierung transgener Obstbäume und
Untersuchungen direkter und indirekter biologischer Wechselwirkungen´)
Auftragnehmer:
Österreichische
Akademie der Wissenschaften
Auftragssumme: 53.269,19
EUR (ATS 733.000.--)
Aufgabe der
Begleitkommission ist die Evaluierung der Sicherheitsforschungsprojekte durch
unabhängige Fachexperten und Dokumentation. Für Anfragen an die Mitglieder der
Begleitkommission wurde eine eigene E-mail-Adresse eingerichtet.
Die Begleitkommission hat
auf Grund der ihr vorgelegten Zwischen- und Endergebnisse generell empfohlen,
die Resultate aus den Projekten in einschlägigen, wissenschaftlichen Zeitschriften
zur Veröffentlichung einzureichen.
Homepage: http://www.oeaw.ac.at/transgene-obstbaeume/
E-mail: Obst@oeaw.ac.at
5.5.3. Zu
gleichen Teilen durch das Bundesministerium für Bildung, Wissenschaft und
Kultur und das Bundesministerium für Land- und Forstwirtschaft, Umwelt und Wasserwirtschaft
finanziert:
Informationen zu den
folgenden Projekten sind im Internet erhältlich:
Homepage: http://www.boku.ac.at/sicherheitsforschung/
E-mail: Sicherheit.Forschung@iam.boku.ac.at
·
"Charakterisierung transgener Obstbäume"
("Charakterisierung transgener Obstbäume und
Untersuchungen direkter und indirekter biologischer Wechselwirkungen")
Auftragnehmer: Institut
für Angewandte Mikrobiologie
Auftragssumme: 480.512,78
EUR (ATS 6.612.000,--)
In
diesem Projekt wurden transgene Steinobstbäume (Marillen und Kirschen)
molekular und biochemisch charakterisiert. Dabei wurde u.a. die Expression des
Transgens im Jahresverlauf und der Fortbestand des Schutzes vor Viren, aber
auch die Wechselwirkung mit verschiedenen Pflanzenviren untersucht werden, d.h.
eine detaillierte Untersuchung der biologischen Vorgänge in den Obstbäumen vorgenommen.
Die
Arbeiten an diesem Projekt sind abgeschlossen. Zum Endbericht über das Projekt
wurden von der wissenschaftlichen Begleitkommission weitere, ergänzende
Untersuchungen verlangt. Die Ergebnisse aus diesen Untersuchungen liegen
nunmehr vor und sollen von der Begleitkommission evaluiert werden.
·
"Untersuchungen an transgenen Obstgehölzen"
("Biologische
und pomologische Untersuchungen bei der stufenweisen Überführung von transgenen
Obstbäumen (Marille und Zierkirsche) in das Saranhaus und ins Freiland")
Auftragnehmer:
Institut
für Obst‑ und Gartenbau
Auftragssumme: EUR
71.268,80 (ATS 980.680,--)
In diesem Projekt wurden
die obstbaulichen (pomologischen) Eigenschaften und das vegetative und
generative Verhalten der Obstbäume geprüft, d.h. Reaktionen beim Veredeln, das
Blüh- und Wachstumsverhalten. Weiters wurde die Kreuzbarkeit zwischen
verwandten Steinobstarten ermittelt. Die Arbeiten an diesem Projekt wurden
abgeschlossen und in einem Endbericht zusammengefasst.
·
"Transgene Obstbäume - phytomedizinische Aspekte"
("Interaktionen zwischen transgenen /
nicht-transgenen Prunus-Arten und phytopathogenen Krankheitserregern,
Blattläusen, sowie Blattlausantagonisten")
Auftragnehmer: Institut
für Pflanzenschutz
Auftragssumme: EUR
211.636,37 (ATS 2,912.180,--)
Ziel: Es sollte geprüft werden, ob die transgenen Bäume
Veränderungen in der Anfälligkeit gegenüber bakteriellen oder pilzlichen
Krankheitserregern zeigen, und ob direkte oder indirekte Auswirkungen auf
Blattlausarten - als wichtigste Virusüberträger - und auf Blattlausantagonisten
(z.B. Marienkäfer) auftreten.
Das Projekt ist
abgeschlossen, die Ergebnisse werden auf Empfehlung der wissenschaftlichen
Begleitkommission der ÖAW in einschlägigen Fachjournalen veröffentlicht.
Bisher
erschienen:
Knoll M.,
Weilguni S., Koschier E.H., Redl H., Steinkellner S. (2004): Seasonal
fluctuation in the flight activity of potential PPV-vector aphids (Homoptera:
Aphididae) in Austrian apricot tree orchards. Journal of Plant Diseases and
Protection, 111, 4, 408-415
·
"Transgene Marillen - Nicht-Zielorganismen"
("Auswirkungen transgener Marillen auf
Blattinhaltsstoffe und in Folge auf Nicht-Zielorganismen ")
Auftragnehmer: Institut
für Forstentomologie, Forstpathologie und Forstschutz
Auftragssumme: EUR
91.943,49 (ATS 1,265.170,--)
In diesem Projekt wurde geprüft, ob die transgenen
Bäume direkte oder indirekte Auswirkungen auf Blatt fressende Insekten haben,
bzw. ob solche Effekte in der tierischen Nahrungskette auftreten. Dazu wird die
Nahrungskette (transgene Wirtspflanzen > Pflanzenfresser > endoparasitische
Schlupfwespe) untersucht. Weiters soll die Krankheitsanfälligkeit der Pflanzenfresser
beobachtet werden. Das Projekt ist abgeschlossen, die Ergebnisse sollen auf
Empfehlung der wissenschaftlichen Begleitkommission der ÖAW in einschlägigen
Fachjournalen veröffentlicht werden.
5.6. Sicherheitsforschung
im EU-Rahmenprogramm
Von der Europäischen Kommission wurde im Jänner
2002 im Zusammenhang mit der Lissabon-Strategie zur Förderung der
Spitzentechnologie die Mitteilung „Biowissenschaften und Biotechnologie: Eine
Strategie für Europa" vorgelegt. Im ersten Fortschrittsbericht über die
Umsetzung der Strategie im Bereich Biowissenschaften und Biotechnologie werden
die in der Zwischenzeit erzielten Fortschritte, die politische Entwicklung und
weitere, sich abzeichnende Fragen aufgezeigt. Sofern weitere Maßnahmen
erforderlich sind, gibt der Bericht Leitlinien für die Zukunft, spricht
Empfehlungen aus und kündigt neue Initiativen an.
In den bisherigen Forschungs-Rahmenprogrammen
der Europäischen Union wurden und werden umfangreiche Untersuchungen von
möglichen Risken und Sicherheitsmaßnahmen bei der Anwendung von gentechnisch
veränderten Organismen finanziert, an denen sich auch österreichische
Forschungsgruppen beteiligen.
Eine Übersicht über die
Projekte des 5. Rahmenprogramms und die Teilnehmer wurde von der Europäischen
Kommission im Internet veröffentlicht:
http://www.europa.eu.int/comm/research/quality-of-life/gmo/index.html