10333/J XXVII. GP
Eingelangt am 24.03.2022
Dieser Text wurde elektronisch übermittelt. Abweichungen vom Original sind
möglich.
ANFRAGE
der Abgeordneten Mag. Gerald Hauser
und weiterer Abgeordneter
an den Bundesminister für Soziales, Gesundheit, Pflege und Konsumentenschutz
betreffend „Neue wissenschaftliche Studie aus Schweden warnt vor Schädigung der DNA durch Spike-Proteine 2“
In der Anfrage 9182/J genannte Studie (abrufbar auf Englisch ist unter: Viruses | Free Full-Text | SARS–CoV–2 Spike Impairs DNA Damage Repair and Inhibits V(D)J Recombination In Vitro | HTML (mdpi.com)) wurde offensichtlich zurückgezogen, wie der Bundesminister in seiner Antwort feststellt:
„Die gegenständliche Studie ist allgemein bekannt. Einerseits für die einfache Fehlinterpretierbarkeit der Ergebnisse der Autor:innen und die dadurch entstehende Irreführung, andererseits dafür, dass die gewählten Methoden Rückschlüsse auf die auch von Ihnen insinuierten Annahmen nicht zulassen. Aus diesem Grund haben die Autor:innen bereits Mitte November diese Studie zurückgezogen und auch die Universitäten Stockholm und Umea haben sich davon distanziert.“
Derzeit ist aber eine weitere Veröffentlichung verfügbar:

Abrufbar unter: CIMB | Free Full-Text | Intracellular Reverse Transcription of Pfizer BioNTech COVID-19 mRNA Vaccine BNT162b2 In Vitro in Human Liver Cell Line (mdpi.com)
Diese Studie schließt die Möglichkeit der Beeinflussung der menschlichen DNA durch mRNA-Impfstoffe nicht aus und fordert weitere Untersuchungen in diese Richtung.
Zusammenfassung der Studie:
„Wir entdeckten hohe BNT162b2-Konzentrationen in Huh7-Zellen und Veränderungen in der Genexpression von Long Interspersed Nuclear Element-1 (LINE-1), das ist eine endogene reverse Transkriptase. Immunhistochemie mit einem Antikörper, der an das RNA-bindende Protein (ORFp1) des offenen Leserahmens 1 von LINE-1 auf Huh7-Zellen, die mit BNT162b2 behandelt wurden, bindet, zeigte eine erhöhte Verteilung von LINE-1 im Zellkern. PCR an genomischer DNA von Huh7-Zellen, die BNT162b2 ausgesetzt waren, amplifizierte die für BNT162b2 einzigartige DNA-Sequenz. Unsere Ergebnisse deuten auf eine schnelle Aufnahme von BNT162b2 in die menschliche Leberzelllinie Huh7 hin, was zu Veränderungen in der Expression und Verteilung von LINE-1 führt. Wir zeigen auch, dass BNT162b2 mRNA intrazellulär in DNA umgeschrieben wird, und zwar innerhalb von 6 Stunden nach der BNT162b2-Exposition.“
Zur Durchführung dieser Studie wurden Huh-7 Zelllinien verwendet, die aus bösartigen Leberzellen gewonnen wurden, die Lebertumoren entstammen. Warum für die Durchführung dieser Studie Huh-7 Zellen verwendet wurden, aber auch die Höhe, der im Versuch verwendeten Dosierung an BNT162b2 Impfstoff, wird von den Wissenschaftlern ausreichend begründet.
Im Bericht über die Toxizität von BNT162b2 wurden, laut Aussagen der Autoren, weder Studien zur Genotoxizität noch zur Karzinogenität vorgelegt. Dieser Sachverhalt ist für die Autoren der Studie von Bedeutung, da sie ausdrücklich darauf hinweisen. Diese Tatsache wurde auch im EMA Assessment Report - Comirnaty 19.02.2021, auf Seite 55 festgehalten und auch wir haben in unserer Anfrage 9250/J (XXVII. GP) bereits auf diesen Sachverhalt hingewiesen.
Die Studie aus Schweden zeigt, dass BNT162b2 in der Leberzelllinie Huh7 in DNA revers transkribiert werden kann. Dies könnte Anlass zur Sorge geben, dass von BNT162b2 abgeleitete DNA in das Wirtsgenom integriert werden und die Integrität der genomischen DNA beeinträchtigen könnte, was möglicherweise genotoxische Nebenwirkungen auslösen kann. Zum gegenwärtigen Zeitpunkt ist laut Angaben der Wissenschaftler unbekannt, ob die von BNT162b2 revers transkribierte DNA in das Zellgenom integriert wird.
Laut den Wissenschaftlern sind weitere Studien
- zu den Auswirkungen von BNT162b2 auf die genomische Integrität,
- zu der Sequenzierung des gesamten Genoms von Zellen, die BNT162b2 ausgesetzt waren, sowie
- von Geweben von Menschen, die mit BNT162b2 geimpft wurden,
erforderlich.
In der genannten Studie aus Schweden wurde nachgewiesen, dass der COVID-19 mRNA-Impfstoff BT162b2 in die menschliche Leberzelllinie Huh7 in vitro eindringen kann. Die Unterschiede aber auch die Ähnlichkeiten zwischen Huh7 Zellen und nicht entarteten Zellen werden von den Wissenschaftlern in dieser Studie erläutert:
„Das Zellmodell, das wir in dieser Studie verwendet haben, ist eine Karzinomzelllinie mit aktiver DNA-Replikation, die sich von nicht teilenden somatischen Zellen unterscheidet. Es hat sich auch gezeigt, dass Huh7-Zellen eine deutlich andere Gen- und Proteinexpression aufweisen, einschließlich hochregulierter Proteine, die am RNA-Stoffwechsel beteiligt sind. Die Zellproliferation ist jedoch auch in mehreren menschlichen Geweben wie dem Knochenmark oder den Basalschichten von Epithelien sowie während der Embryogenese aktiv, weshalb die Wirkung von BNT162b2 auf die genomische Integrität unter solchen Bedingungen untersucht werden muss. Darüber hinaus wurde eine wirksame Retrotransposition von LINE-1 auch in sich nicht teilenden und terminal differenzierten Zellen, wie z. B. menschlichen Neuronen, beobachtet. Der EMA-Assessment Report von Pfizer zeigte auch, dass BNT162b2 in der Milz (<1,1 %), den Nebennieren (<0,1 %) sowie eine geringe und messbare Radioaktivität in den Eierstöcken und Hoden (<0,1%).“
Laut Angaben von Public Health Scotland z.B. wurde bereits ein Anstieg von Eierstockkrebserkrankungen bis 14.06.2021 gegenüber den Jahren 2019 und 2021 verzeichnet.
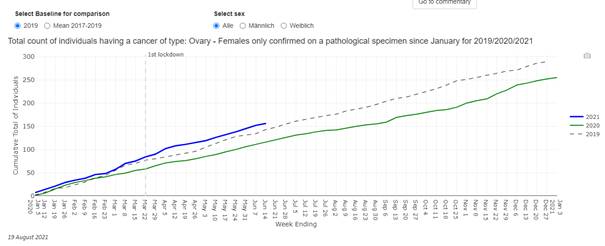
https://scotland.shinyapps.io/phs-covid-wider-impact/
Da der Inhalt der vorliegenden Studie aus Schweden mit Bezug auf die Sicherheit des Pfizer/BioNTech mRNA-Impfstoffs BNT162b2 Comirnaty von entscheidender Bedeutung ist, wird von einer dringenden Überprüfung seitens des Bundesministeriums ausgegangen.
In diesem Zusammenhang richten die unterfertigten Abgeordneten an den Bundesminister für Soziales, Gesundheit, Pflege und Konsumentenschutz folgende
Anfrage
1) Wurde oder wird diese Studie und ihre Erkenntnisse in Österreich in irgendeiner Form überprüft?
a) Falls ja, mit welchem Ergebnis?
b) Falls ja, wo sind die Ergebnisse nachzulesen?
c) Falls nein, wieso nicht?
2) Wie lautet die Stellungnahme des Bundesministeriums zu den Erkenntnissen, die in dieser Studie angeführt werden?
3) Welche schriftlichen Stellungnahmen der EMA gibt es zu den Erkenntnissen, die in dieser Studie angeführt werden?
4) Haben europäische behördliche Arzneimittelkontrolllabore (OMCL`s) die Erkenntnisse, die in dieser Studie angeführt werden, überprüft, welche schriftlichen Stellungnahmen gibt es?
5) Welche schriftlichen Stellungnahmen gibt es vom European Directorate for the Quality of Medicines & HealthCare (EDQM), zu den Erkenntnissen, die in dieser Studie angeführt werden?
6) Wie lautet die Stellungnahme von BASG/AGES MEA zu den Erkenntnissen, die in dieser Studie angeführt werden?
7) Kann das Bundesministerium ausschließen, dass es durch die mRNA-Impfstoffe zu einer Veränderung der menschlichen DNA kommt?
8) Wird das Impfen mit mRNA-Impfstoffen bis zur endgültigen Klärung der oben genannten Inhalte der Studie ausgesetzt?
9) Welche Studien, Analysen, Bestätigungen und Dokumente der EMA, von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s), vom European Directorate for the Quality of Medicines & HealthCare (EDQM) belegen, dass es zu keiner Veränderung der menschlichen DNA durch mRNA-Impfungen kommen kann?
10) Hat sich das Bundesministerium darüber informiert, warum der Covid-19-Impfstoff von Pfizer/BioNTech Comirnaty bei -90 bis -60 Grad Celsius gelagert werden muss?
a) Welcher Bestandteil des Impfstoffes benötigt diese extrem niedrige Temperatur?
b) Was würde passieren, wenn dieser Impfstoff wärmer gelagert wird?
c) Falls nein, warum nicht, es handelt sich nämlich um eine unüblich niedrige Temperatur?
d) Welche schriftlichen Informationen sind zu diesen Fragen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s), vom European Directorate for the Quality of Medicines & HealthCare (EDQM) verfügbar?
e) Welche schriftlichen Informationen sind von BASG/AGES MEA zu diesen Fragen verfügbar?
11) Hat sich das Bundesministerium informiert, welche Veränderungen macht der Pfizer/BioNTech mRNA-Impfstoffe Corminaty durch, wenn dieses Vakzin durchschnittlicher menschlichen Körpertemperatur ausgesetzt ist?
a) Falls ja, welche Antwort haben Sie erhalten?
b) Falls nein, gibt es Untersuchungen und Informationen außerhalb des Bundesministeriums zu diesem Thema?
c) Falls nein, warum nicht?
d) Welche schriftlichen Informationen zu diesen Fragen sind von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) und vom European Directorate for the Quality of Medicines & HealthCare (EDQM) verfügbar?
e) Welche schriftlichen Informationen sind von BASG/AGES MEA zu diesem Sachverhalt verfügbar?
12) Laut EMA Assessment Report (Seite 17) 19.02.2021 zum (Pfizer)/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty galt die Robustheit des DNase-Verdauungsschritts zur Herstellung der synthetischen mRNA als nicht umfassend nachgewiesen. Im Verdauungsschritt mit DNase werden jedoch, laut Fachkreisen, DNA-Kontaminationen effizient entfernt, einschließlich hochfragmentierter Moleküle. Laut Fachkreisen muss DNA aufgrund einer möglichen onkogenen Wirkung aus dem Endprodukt entfernt werden.
a) Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
b) Mit welchen Informationen, und schriftlichen Bestätigungen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) wird dokumentiert, dass die Robustheit des DNase-Verdauungsschritts umfassend nachgewiesen wurde?
c) Hat das European Directorate for the Quality of Medicines & HealthCare (EDQM), die völlige Unbedenklichkeit mit Bezug auf diesen Sachverhalt bestätigt?
d) Welche Informationen, Dokumente und schriftlichen Bestätigungen mit Bezug auf DNA-Kontaminationen liegen vom European Directorate for the Quality of Medicines & HealthCare (EDQM) mit Bezug auf diesen Sachverhalt vor?
e) Welche Informationen und Bestätigungen mit Bezug auf DNA- Kontaminationen im Arzneimittel sind in den EU-Zertifikaten zu den Impfstoffchargen zu finden?
f) Verfügen das Bundesministerium oder BASG/AGES MEA über Unterlagen, die bestätigen, dass der DNase Verdauungsschritt vollständig nachgewiesen wurde oder über mögliche DNA-Kontaminationen im Arzneimittel?
g) Verfügen das Bundesministerium oder BASG/AGES MEA über Unterlagen zu prozess- und produktbedingten Kontaminationen in den Covid-19-Impfstoffen?
h) Wie lautet die Stellungnahme von BASG/AGES MEA zu diesem Sachverhalt?
i) Da die Chargen in EU/EWR, laut Auskunft Bundesministerium, ohnehin vor dem Inverkehrbringen von Arzneimittellaboren getestet werden, scheint aus Sicht des BASG eine Nachtestung nicht zweckmäßig. Wurden die Verunreinigungen in den Covid-19-Impfstoffen vom Bundesministerium oder BASG/AGES MEA trotzdem auf onkogene Eigenschaften und produktbedingte und prozessbedingte Verunreinigungen untersucht?
i. Existieren entsprechende Analysen?
ii. Gibt es dazu schriftliche Bestätigungen?
13) Laut EMA Assessment Report 19.02.2021 (Seite 20) wurde als produktbezogene Verunreinigung, doppelsträngige mRNA in der Wirksubstanz angesprochen, die aus der In-vitro-Transkriptionsreaktion stammt. Doppelsträngige mRNA im Impfstoff könnte sich negativ auf die Wirksamkeit des Produkts auswirken.
a) Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
b) Existieren Informationen, Dokumente und schriftliche Bestätigungen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) über doppelsträngige mRNA im Arzneimittel und existieren Analysen zur Auswirkung auf die Wirksamkeit des Arzneimittels?
c) Welche Informationen und Bestätigungen zur doppelsträngigen mRNA sind in den EU-Zertifikaten zu den Impfstoffchargen festgehalten?
d) Welche schriftliche Stellungnahme hat das European Directorate for the Quality of Medicines & HealthCare (EDQM) bezüglich der doppelsträngigen mRNA mit Bezug auf die Wirksamkeit des Arzneimittels veröffentlicht?
e) Verfügen Bundesministerium oder BASG/AGES MEA über Informationen und Dokumente, die bestätigen, dass die doppelsträngige mRNA im Arzneimittel zu keiner Beeinträchtigung der Wirksamkeit führt?
14) Innerhalb welcher genauen Zeitspanne wird die synthetische mRNA der Covid-19-Impfstoffe nach der Produktion des Spike-Proteins wieder vollständig abgebaut?
a) Welche Informationen, Dokumente und schriftlichen Bestätigungen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) liegen zu dieser Frage vor?
15) Die synthetische mRNA befindet sich im Kern der Lipidnanopartikel zusammen mit den kationischen Lipidkomponenten und Wasser,
a) ist die synthetische mRNA vor Wasser abgeschirmt?
b) wie ist die die synthetische mRNA vor Wasser abgeschirmt?
c) ist es möglich, dass die synthetische mRNA mit Wasser interagiert und was könnten die Folgen sein?
d) Wie beeinflussen die derzeitigen mRNA-Impfstoffformulierungen die Stabilität des Pfizer/BioNTech mRNA-Impfstoffs BNT162b2 Comirnaty bei der Lagerung?
e) Über welche Informationen, Dokumente und schriftliche Bestätigungen verfügt das Bundesministerium zu diesen Fragen?
f) Welche Informationen, Dokumente und schriftliche Bestätigungen mit Bezug auf diese Fragen liegen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) vor?
g) Welche Informationen, Dokumente und schriftliche Bestätigungen mit Bezug auf diese Fragen liegen vom European Directorate for the Quality of Medicines & HealthCare (EDQM) vor?
h) Welche Informationen und Bestätigungen mit Bezug auf diese Fragen sind in den EU- Zertifikaten zu den Impfstoffchargen zu finden?
i) Über welche Informationen, Dokumente und schriftliche Bestätigungen verfügen BASG/AGES MEA zu diesen Fragen?
16) Können die kationischen Lipidkomponente im Kern der Lipidnanopartikel mit der synthetischen mRNA interagieren, die sich ebenfalls im Kern der Lipidnanopartikel befindet?
a) Wenn ja, was können die Folgen dieser Interaktion sein?
b) Wenn nein, auf welche wissenschaftlichen Beweise stützen Sie ihre Aussage?
d) Welche Informationen, Dokumente und schriftliche Bestätigungen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) liegen mit Bezug auf diese Fragen vor?
e) Welche Informationen, Dokumente und schriftlichen Bestätigungen vom European Directorate for the Quality of Medicines & HealthCare (EDQM) liegen mit Bezug auf diese Fragen vor?
f) Welche Informationen und Bestätigungen mit Bezug auf diese Fragen sind in den EU- Zertifikaten zu den Impfstoffchargen zu finden?
g) Über welche Informationen, Dokumente und schriftlichen Bestätigungen verfügen BASG/AGES MEA zu diesen Fragen?
17) Laut EMA Assessment Report 19.02.2021 (Seite 32) enthält der Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty verkürzte RNA Spezies. Verkürzte RNA Spezies wurden von der EMA als Verunreinigungen angesehen. Da Laut EMA Assessment Report 19.02.2021 (Seite 33) die Gesamtbeschreibung der verkürzten Spezies jedoch noch begrenzt war, sollten zusätzliche Analysen der verkürzten Spezies vorgelegt werden, um zu belegen, dass sie die klinische Leistung, in Bezug auf Sicherheit und/oder Wirksamkeit nicht beeinträchtigen. Laut EMA Assessment Report 19.02.2021 (Seite 35) spiegelte der hohe Anteil dieser Verunreinigungen die Instabilität der RNA wider. Laut EMA Assessment Report 19.02.2021 (Seite 33) sollte eine zusätzliche Beschreibung der übersetzten Proteine vorgelegt werden, um zu belegen, dass sie die klinische Leistung, in Bezug auf Sicherheit und/oder Wirksamkeit nicht beeinträchtigen. Wie im EMA Assessment Report 19.02.2021 (Seite137) festgehalten wurde, belegten Daten das Vorhandensein von verkürzten/veränderten Formen der mRNA in etwas höheren Mengen in den, mit dem kommerziellen Verfahren hergestellten Chargen, im Vergleich zu dem in klinischen Studien verwendeten Material. Diese Formen waren nicht ausreichend charakterisiert, und obwohl die begrenzten Daten, die für die Proteinexpression zur Verfügung gestellt wurden, die Unsicherheiten in Bezug auf das Risiko der Translation von anderen Proteinen/Peptiden als dem beabsichtigten Spike-Protein nicht vollständig ausräumten, dürfte die Menge solcher Proteine laut EMA zu gering sein, um eine biologisch relevante Immunantwort auszulösen. In der Beantwortung 9101/AB auf unsere Anfrage 9250/J (XXVII. GP) zur Frage mit Bezug auf verkürzte mRNA im Pfizer/BioNTech mRNA-Impfstoffs BNT162b2 Comirnaty wurde erklärt: „Im Rahmen der behördlichen Chargenprüfung durch das verantwortliche OMCL wird entsprechend den Vorgaben des Europäischen Direktorates für die Qualität von Arzneimitteln (European Directorate for the Quality of Medicines & HealthCare, EDQM) für pandemische COVID-19 mRNA Impfstoffe u.a. die Integrität der enthaltenen mRNA für jede Charge von Comirnaty experimentell bestimmt.“ Im EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty unter Punkt spezifische Verpflichtung SO1(a) sind erneut, vor allem sicherheitsrelevante Angaben mit Bezug auf verkürzte mRNA zu finden. Genauere Details entnehmen Sie bitte unserer Frage zur spezifischen Verpflichtung SO1(a).
a) Verfügt das Bundesministerium über Informationen Dokumente und schriftliche Bestätigungen zu den verkürzten mRNA-Spezies und den übersetzten Proteinen in den mRNA-Impfstoffen?
b) Welche Informationen, Dokumente und schriftliche Bestätigungen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) liegen zu diesem Sachverhalt vor?
c) Welche Informationen, Dokumente und schriftliche Bestätigungen vom European Directorate for the Quality of Medicines & HealthCare (EDQM liegen zu diesem Sachverhalt vor?
d) Welche Informationen und Bestätigungen mit Bezug auf diesen Sachverhalt sind in den EU-Zertifikaten zu den Impfstoffchargen zu finden?
e) Über welche Informationen, Dokumente und schriftlichen Bestätigungen verfügen BASG/AGES MEA zu diesem Sachverhalt?
18) Laut EMA Assessment Report 19.02.2021 (Seite 33) sollte eine zusätzliche Beschreibung der lipidbedingten Verunreinigungen und der möglichen Lipid-RNA-Spezies vorgelegt werden, um zu belegen, dass sie die klinische Leistung, in Bezug auf Sicherheit und/oder Wirksamkeit nicht beeinträchtigen. In der Beantwortung 9101/AB auf unsere Anfrage 9250/J (XXVII. GP) zur Frage mit Bezug auf lipidbedingte Verunreinigungen im Pfizer/BioNTech mRNA-Impfstoffs BNT162b2 Comirnaty wurde erklärt: „Wie im EMA Bewertungsbericht („EPAR – Public Assessment Report“) ausgeführt, enthielten Comirnaty-Chargen Lipid-bedingte Verunreinigungen, die aufgrund der geringen Menge jedoch als toxikologisch unbedenklich eingestuft wurden. Hinsichtlich der behördlichen Überprüfung und Freigabe jeder Charge wird auf die Antwort der Frage 14 verwiesen.“ Laut EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty sind lipidbedingte Verunreinigungen laut Eintrag spezifische Verpflichtung SO2 (f) nach wie vor im Wirkstoff vorhanden. Genauere Details entnehmen sie bitte unserer Frage zur spezifischen Verpflichtung SO2 (f).
Im EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty (Seite 5) ist die spezifische Verpflichtung 1 (SO1): festgelegt: Beschreibung (Umfang): „Um die Beschreibung des Wirkstoffs und des Fertigerzeugnisses Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty zu vervollständigen, sollte der Zulassungsinhaber zusätzliche Daten vorlegen.“ Fälligkeitsdatum angegeben in Anhang II Juli 2021, Datum der Einreichung: 02.08.2021, aktueller Status: nicht erfüllt
a) Wie lautet die Stellungnahme des Bundesministeriums zur Nichterfüllung der spezifischen Verpflichtung 1 (SO1)?
b) Die Beschreibung des Wirkstoffs Pfizer/BioNTech mRNA-Impfstoff und Fertigerzeugnisses BNT162b2 Comirnaty war auch zum Zeitpunkt der jährlichen Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Arzneimittels nicht vollständig, der Zulassungsinhaber sollte zusätzliche Daten vorlegen. Die spezifische Verpflichtung 1 (SO1) wurde als nicht erfüllt vermerkt. Warum wird dieses Arzneimittel trotz dieses Sachverhalts als wirksam und sicher bezeichnet?
c) Wie lauten die schriftlichen Stellungnahmen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) in Österreich, Deutschland, Niederlande, Belgien und Frankreich zur Nichterfüllung der spezifischen Verpflichtung 1 (SO1)? (Bitte um entsprechende Dokumente/Bestätigungen.)
d) Die spezifische Verpflichtung 1 (SO1) wurde nicht erfüllt, warum wurden und werden trotzdem weiterhin EU-Zertifikate für die Impfstoffchargen ausgestellt?
f) Wie lautet die schriftliche Stellungnahme des European Directorate for the Quality of Medicines & HealthCare (EDQM) hinsichtlich der Nichterfüllung der spezifischen Verpflichtung 1 (SO1)? (Bitte um entsprechende Dokumente/Bestätigungen.)
g) Wie lauteten die Stellungnahmen von BASG/AGES MEA hinsichtlich der Nichterfüllung der spezifischen Verpflichtung 1 (SO1)?
19) EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty Spezifische Verpflichtung SO1(a) (Seite 5) Beschreibung (Umfang) lautet: „Es sollen zusätzliche Daten zur weiteren Charakterisierung der im Endprodukt vorhandenen verkürzten und modifizierten mRNA-Spezies vorgelegt werden. Es wird erwartet, dass sich die Daten auf die in klinischen Studien verwendeten Chargen (für die die Charakterisierungsdaten früher verfügbar sein könnten) und auf die PPQ-Chargen beziehen. Diese Daten sollten sich auf die Ergebnisse der Ionenpaar-RP-HPLC beziehen, die den Gehalt an 5'-Cap und das Vorhandensein des Poly(A)-Schwanzes betreffen. Diese Daten sollten auch das Potenzial für die Umsetzung in Bewertungsbericht EMA/707383/2020 Seite 37/140 verkürzte S1S2-Proteine/Peptide oder andere Proteine/Peptide berücksichtigen. Relevante Protein-/Peptidcharakterisierungsdaten für die vorherrschenden Spezies sollten vorgelegt werden. Jegliche Homologie zwischen übersetzten Proteinen (mit Ausnahme des vorgesehenen Spike-Proteins) und menschlichen Proteinen, die aufgrund von molekularer Mimikry möglicherweise einen Autoimmunprozess auslösen könnten, sollte bewertet werden.“ Fälligkeitsdatum angegeben in Anhang II Juli 2021, Datum der Einreichung: 02.08.2021, aktueller Status: fortlaufend. In der Mikrobiologie beschreibt molekulare Mimikry die Tarnung von Mikroorganismen (z.B. Viren und Bakterien) durch Oberflächenstrukturen, die molekulare Komponenten des Wirts nachahmen. Durch diese Tarnung entgehen diese Mikroben der Immunabwehr des Körpers, da sie nicht als fremd erkannt werden (Immunevasion). Eine unbehandelte Autoimmunerkrankung kann durch schwere Entzündungsreaktionen zur Zerstörung des betroffenen Organs und in bestimmten Fällen mit schwerem Verlauf (mit Systembeteiligung) zum Tod führen - IMD Institut für medizinische Diagnostik - Berlin. Es zeigte sich auch, dass die meisten Autoimmunerkrankungen das Krebsrisiko für die Betroffenen erhöhen - Deutsches Krebsforschungszentrum. Die Ausführungen der EMA zur spezifischen Verpflichtung SO1(a) stehen in großem Widerspruch zur Aussage: „Im Rahmen der behördlichen Chargenprüfung durch das verantwortliche OMCL wird entsprechend den Vorgaben des Europäischen Direktorates für die Qualität von Arzneimitteln (European Directorate for the Quality of Medicines & HealthCare, EDQM) für pandemische COVID-19 mRNA Impfstoffe u.a. die Integrität der enthaltenen mRNA für jede Charge von Comirnaty experimentell bestimmt.“
a) Wie lautet die Stellungnahme des Bundesministeriums mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO1(a) und zu den sicherheitsrelevanten Aussagen im EMA Bericht?
b) Warum wird das Arzneimittel trotz dieses Sachverhalts als wirksam und sicher bezeichnet?
c) Wie lauten die schriftlichen Stellungnahmen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) in Österreich, Deutschland, Niederlande, Belgien und Frankreich mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO1(a)? (Bitte um entsprechende Dokumente/Bestätigungen.)
d) Der Inhalt der Spezifischen Verpflichtung SO1(a) stellt eine große mögliche Gefährdung der Sicherheit von Patienten dar, warum wurden und werden trotzdem weiterhin EU-Zertifikate für Impfstoffchargen ausgestellt?
e) Der Inhalt der Spezifischen Verpflichtung SO1 (a) stellt eine mögliche Bedrohung der Sicherheit von Patienten dar, warum entsprachen die Impfstoffchargen trotzdem dem in der Zulassung genehmigten Herstellungsprozess und den Spezifikationen?
f) Wie lautet die schriftliche Stellungnahme des European Directorate for the Quality of Medicines & HealthCare (EDQM) mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO1 (a)? (Bitte um entsprechende Dokumente/Bestätigungen.)
g) Wie lauteten die Stellungnahmen von BASG/AGES MEA mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO1 (a)?
20) EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty - Spezifische Verpflichtung 2 (SO2) (Seite 6) lautet Beschreibung (Umfang): „Um eine gleichbleibende Produktqualität zu gewährleisten, sollte der Zulassungsinhaber zusätzliche Informationen zur Verbesserung der Kontrollstrategie, einschließlich der Wirkstoff- und Fertigproduktspezifikationen vorlegen“, die Fälligkeitsdatum angegeben in Anhang II: Juli 2021; Datum der Einreichung: 02.08.2021; aktueller Status: nicht erfüllt.
a) Wie lautet die Stellungnahme des Bundesministeriums zur Nichterfüllung der spezifischen Verpflichtung 2 (SO2), da zur Gewährleistung einer gleichbleibenden Produktqualität vom Zulassungsinhaber zusätzliche Informationen zur Verbesserung der Kontrollstrategie, einschließlich der Wirkstoff- und Fertigproduktspezifikationen vorgelegt werden sollten?
b) Warum wird der Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty trotz der Nichterfüllung der spezifischen Verpflichtung 2 (SO2) als wirksam und sicher bezeichnet?
d) Die spezifische Verpflichtung 2 (SO2) wurde nicht erfüllt, warum wurden und werden trotzdem weiterhin EU-Zertifikate für Impfstoffchargen ausgestellt?
e) Die spezifische Verpflichtung 2 (SO2) wurde nicht erfüllt, warum entsprachen die Impfstoffchargen trotzdem dem in der Zulassung genehmigten Herstellungsprozess und den Spezifikationen?
g) Wie lautet die Stellungnahme von BASG/AGES MEA hinsichtlich der Nichterfüllung der spezifischen Verpflichtung 2 (SO2)?
21) EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty - Spezifische Verpflichtung SO2 (b) (Seite 6) Beschreibung (Umfang) lautet: „Die Poly(A)-Schwanzlänge wird als kritisches Merkmal betrachtet, das bei jeder Charge kontrolliert werden sollte, auch wenn bisher vergleichbare Ergebnisse erzielt wurden. Eine Wirkstoffspezifikation zur Kontrolle der Poly(A)-Länge sollte eingeführt werden. Es sollte eine geeignete Methode entwickelt werden, und geeignete Akzeptanzkriterien sollten festgelegt werden.“ Fälligkeitsdatum angegeben in Anhang II: Juli 2021, Datum der Einreichung: 02.08.2021, aktueller Status: fortlaufend.
Die Qualität von Wirkstoffen und Fertigarzneimitteln ist gekennzeichnet durch deren Spezifikationen. Sie werden während der Entwicklung geplant und durch Einhaltung der GMP-Anforderungen wie beispielsweise Inprozesskontrollen, Umfeldkontrollen sowie durch validierte Prozesse während der Herstellung garantiert. Eine international einheitliche Spezifikation steht für einen weltweit vergleichbaren Qualitätsstandard von Arzneimitteln, wodurch im Sinne der Arzneimittelsicherheit auch Unbedenklichkeit und Wirksamkeit deutlich transparenter werden - Pharmazeutische Zeitung. Im EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty erklärt die EMA, dass die Poly(A)-Schwanzlänge als kritisches Merkmal betrachtet wird, das bei jeder Charge kontrolliert werden sollte. Eine Wirkstoffspezifikation zur Kontrolle der Poly(A)-Länge sollte eingeführt werden. Es sollte eine geeignete Methode entwickelt werden, und geeignete Akzeptanzkriterien sollten festgelegt werden. Die Poly(A)-Schwanzlänge, die von der EMA als kritisches Merkmal angesehen wird, wird vom Hersteller also nicht bei jeder Charge kontrolliert. Eine Wirkstoffspezifikation zur Kontrolle der Poly(A)-Länge existiert laut EMA ebenfalls nicht. Der aktuelle Status wurde als fortlaufend vermerkt. Diese Aussagen der EMA erwecken keinesfalls den Eindruck, dass der Wirkstoff als wirksam und sicher bezeichnet werden kann. Wie lautet die Stellungnahme des Bundesministeriums betreffend des Sachverhalts in der spezifischen Verpflichtung SO2 (b)?
a) Warum wird das Arzneimittel trotz dieses Sachverhalts (siehe oben) als wirksam und sicher bezeichnet?
b) Wie lauten die schriftlichen Stellungnahmen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) in: Österreich, Deutschland, Niederlande, Belgien und Frankreich mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO2 (b)? (Bitte um entsprechende Dokumente/Bestätigungen.)
c) Die Poly(A)-Schwanzlänge wurde von der EMA als kritisches Merkmal betrachtet, das bei jeder Charge kontrolliert werden sollte. Eine Wirkstoffspezifikation zur Kontrolle der Poly(A)-Länge sollte eingeführt werden. Es sollte eine geeignete Methode entwickelt werden, und geeignete Akzeptanzkriterien sollten festgelegt werden. Warum wurden und werden trotzdem weiterhin EU-Zertifikate für Impfstoffchargen ausgestellt?
d) Warum entsprachen alle freigegebenen Chargen trotz dieses Sachverhalts mit Bezug auf die spezifische Verpflichtung SO2 (b) dem in der Zulassung genehmigten Herstellungsprozess und den Spezifikationen?
e) Wie lautet die schriftliche Stellungnahme des European Directorate for the Quality of Medicines & HealthCare (EDQM) mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO2 (b)? (Bitte um entsprechende Dokumente/Bestätigungen.)
f) Wie lautet die Stellungnahme von BASG/AGES MEA mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO2 (b)?
22) EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty - Spezifische Verpflichtung SO2 (d) (Seite7) Beschreibung (Umfang): „Da es sich bei der mRNA-Integrität und der Polydispersität um CQAs (kritische Qualitätsattribute) für die Wirksamkeit des Arzneimittels Pfizer/BioNTech Comirnaty handelt, sollten die Akzeptanzkriterien für das Fertigerzeugnis für diese Parameter überarbeitet werden, sobald weitere Daten aus den laufenden klinischen Prüfungen vorliegen, und zwar in Übereinstimmung mit den Möglichkeiten des Herstellungsprozesses.“ Fälligkeitsdatum angegeben in Anhang II: Juli 2021, Datum der Einreichung: 02.08.2021, aktueller Status: fortlaufend.
a) Wie lautet die Stellungnahme des Bundesministeriums mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO2 (d)?
b) Die RNA-Integrität wurde von der EMA als kritisches Qualitätsmerkmal für die Wirksamkeit des Wirkstoffs Pfizer/BioNTech (mRNA-Impfstoff BNT162b2 Cominaty) bezeichnet, der aktuelle Status wurde von der EMA als fortlaufend vermerkt, warum wird das Arzneimittel trotzdem als wirksam bezeichnet?
c) Wie lauten die schriftlichen Stellungnahmen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) in Österreich, Deutschland, Niederlande, Belgien und Frankreich mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO2 (d)? (Bitte um entsprechende Dokumente/Bestätigungen.)
d) Warum wurden und trotz dieses Sachverhalts mit Bezug auf die spezifische Verpflichtung SO2 (d) weiterhin EU-Zertifikate für Impfstoffchargen ausgestellt?
e) Warum entsprachen die Impfstoffchargen trotz dieses Sachverhalts mit Bezug auf die spezifische Verpflichtung SO2 (d) dem in der Zulassung genehmigten Herstellungsprozess und den Spezifikationen?
g) Wie lauteten die Stellungnahmen von BASG/AGES mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung SO2 (d)?
23) EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty - Spezifische Verpflichtung (SO2) (f) (Seite7) Beschreibung (Umfang): „Lipidbedingte Verunreinigungen im Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty sollten weiter bewertet werden, eine geeignete Kontrollstrategie sollte eingeführt, angemessen begründet und zur Bewertung im zweiten Quartal 2021 vorgelegt werden“. Fälligkeitsdatum angegeben in Anhang II: Juli 2021, Datum der Einreichung: 26.07.2021, aktueller Status: fortlaufend. Die Antwort des Bundesministeriums mit Bezug auf unsere Anfrage lautete: „Wie im EMA Bewertungsbericht („EPAR – Public Assessment Report“) ausgeführt, enthielten Comirnaty-Chargen Lipid-bedingte Verunreinigungen, die aufgrund der geringen Menge jedoch als toxikologisch unbedenklich eingestuft wurden.“ Aus dem EMA Assessment Report vom 14. 10. 2021 über die jährliche Erneuerung der bedingten Genehmigung für das Inverkehrbringen des Pfizer/BioNTech mRNA-Impfstoff BNT162b2 Comirnaty geht jedoch nun hervor, dass mit Bezug auf lipidbedingte Verunreinigungen weitere Bewertungen durchgeführt werden sollten und eine geeignete Kontrollstrategie eingeführt und angemessen begründet werden und zur Bewertung vorgelegt werden sollte.
a) Wie lautet die Stellungnahme des Bundesministeriums mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung (SO2) (f)?
b) Mit Bezug auf lipidbedingte Verunreinigungen sollten weitere Bewertungen durchgeführt werden und eine geeignete Kontrollstrategie eingeführt und angemessen begründet werden und zur Bewertung vorgelegt werden, warum wird das Arzneimittel trotzdem als sicher und wirksam bezeichnet?
c) Wie lauten die schriftlichen Stellungnahmen von europäischen behördlichen Arzneimittelkontrolllaboren (OMCL`s) in Österreich, Deutschland, Niederlande, Belgien und Frankreich mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung (SO2) (f)? (Bitte um entsprechende Dokumente/Bestätigungen.)
d) Warum wurden und trotz dieses Sachverhalts mit Bezug auf die Verpflichtung (SO2) (f) weiterhin EU-Zertifikate für Impfstoffchargen ausgestellt?
e) Warum entsprachen die Impfstoffchargen trotz dieses Sachverhalts mit Bezug auf die Verpflichtung (SO2) (f) dem in der Zulassung genehmigten Herstellungsprozess und den Spezifikationen?
f) Wie lautet die schriftliche Stellungnahme des European Directorate for the Quality of Medicines & HealthCare (EDQM) mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung (SO2) (f)? (Bitte um entsprechende Dokumente/Bestätigungen.)
g) Wie lautet die Stellungnahme von BASG/AGES MEA mit Bezug auf den Sachverhalt in der spezifischen Verpflichtung (SO2) (f)?