3652/AB XXII. GP
Eingelangt am
09.02.2006
Dieser Text wurde elektronisch übermittelt. Abweichungen vom Original sind
möglich.
BM für Gesundheit und Frauen
Anfragebeantwortung

Herrn
Präsidenten
des Nationalrates
Dr.
Andreas Khol
Parlament
1017
Wien
Wien, am 7. Februar 2006
GZ: BMGF-11001/0159-I/3/2005
Sehr geehrter Herr Präsident!
Ich beantworte die an mich gerichtete schriftliche parlamentarische
Anfrage Nr. 3713/J der Abgeordneten Mag. Johann Maier und GenossInnen wie folgt:
Frage 1:
Der Hauptverband der österreichischen Sozialversicherungsträger gab
dazu folgende Stellungnahme ab:
„Die Anfrage zitiert eine Public Health Advisory der FDA, welche sich mit Arzneispezialitäten befasst, die langwirksame beta-Mimetika (LABA), nämlich Formoterol und Salmeterol, enthalten.
Diese Wirkstoffe sind in folgenden im Erstattungskodex (Stand Jänner 2006) angeführten Arzneispezialitäten enthalten:
|
Box* |
Zusammensetzung/ |
Bezeichnung der
Arzneispezialität |
Kassenzeichen |
Packungsgröße |
|
G |
Formoterol
6 mcg/Hub |
Oxis
Turbohaler 6 mcg Dosier-Pulverinhalator |
IND |
1 St |
|
G |
Formoterol
12 mcg/Hub |
Foradil Dosieraerosol |
IND |
1 St |
|
G |
Formoterol 12 mcg/Hub |
Oxis Turbohaler 12 mcg Dosier-Pulverinhalator |
IND |
1 St |
|
G |
Formoterol 12 mcg/Kps |
Foradil Kaps. z. Trockeninh. |
IND |
60 St |
|
G |
Salmeterol 50 mcg/Hub |
Serevent
Diskus Pulver z. Trockeninh. |
IND |
1 St |
|
G |
Salmeterol 50 mcg/Hub |
Serevent Rotadisks Pulver z. Trockeninh. |
IND |
1 St |
|
G |
Formoterol 4,5 mcg + Budesonid 160 mcg |
Symbicort
Turbohaler Dosier-Pulverinhalator |
IND |
1 St |
|
G |
Formoterol 4,5 mcg + Budesonid 80 mcg |
Symbicort
mite Turbohaler Dosier-Pulverinhalator |
IND |
1 St |
|
G |
Salmeterol 25 mcg + Fluticasonpropionat 125 mcg |
Seretide standard 25/125 mcg/Sprühstoß Dosieraerosol |
IND |
1 St |
|
G |
Salmeterol 25 mcg + Fluticasonpropionat 50 mcg |
Seretide
junior 25/50 mcg/Sprühstoß Dosieraerosol |
IND |
1 St |
|
G |
Salmeterol 25 mcg/Hub |
Serevent Dosieraerosol |
IND |
1 St |
|
G |
Salmeterol 50 mcg + Fluticasonpropionat 100 mcg |
Seretide
Diskus junior 0,05 mg/0,1 mg Plv. z. Inh. |
IND |
60 St |
|
G |
Salmeterol 50 mcg + Fluticasonpropionat 250 mcg |
Seretide
Diskus standard 0,05 mg/0,25 mg Plv. z. Inh. |
IND |
60 St |
|
G |
Salmeterol 50 mcg + Fluticasonpropionat 500 mcg |
Seretide
Diskus forte 0,05 mg/0,5 mg Plv. z. Inh. |
IND |
60 St |
|
Y |
Formoterol 12 mcg/Hub |
Foradil Dosieraerosol 9,2 g |
RE1 |
1 St |
|
Y |
Formoterol 9 mcg + Budesonid 320 mcg |
Symbicort forte Turbohaler Dosier-Pulverinhalator |
RE1 |
1 St |
|
Y |
Salmeterol 25
mcg + Fluticasonpropionat 250 mcg |
Seretide forte 25/250 mcg/Sprühstoß Dosieraerosol |
RE1 |
1 St |
* G = Grüner Bereich, Y = Gelber Bereich
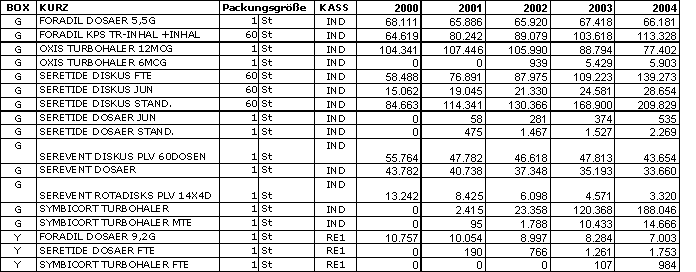
Die Anzahl der
Verordnungen bzw. Packungen, für welche seitens der sozialen
Krankenversicherungsträger Kosten übernommen wurden, ist wie folgt:
Wir
erlauben uns den Hinweis, dass es sich bei diesen Daten um datenschutzrechtlich
relevante Daten der betroffenen pharmazeutischen Unternehmen handelt.“
Frage 2:
Serevent® und Advair® enthalten als
wirksamen Bestandteil Salmeterol. Foradil® enthält als wirksamen
Bestandteil Formoterol.
Aus
den bei der österreichischen Behörde eingelangten Nebenwirkungs-meldungen
ergeben sich keine Hinweise auf ein durch Salmeterol- oder Formoterol-haltige
Arzneispezialitäten verursachtes Auftreten von tödlichen Asthmaanfällen.
Fragen 3 und 4:
Seit
dem Jahr 2000 sind bei meinem Ressort folgende österreichische Meldungen über
Arzneimittelnebenwirkungen eingelangt, bei denen Salmeterol haltige
Arzneispezialitäten als Verursacher angegeben wurden:
|
Jahr |
Zahl
der Meldungen |
|
|
2000 |
1 |
Übelkeit |
|
2001 |
1 |
Kopfschmerzen,
Augenbrennen, Herzklopfen, Schlafstörung |
|
2002 |
0 |
|
|
2003 |
2 |
a) Angstzustände,
Schlaflosigkeit, Tremor, Schweißausbrüche,
zeitweise Tinnitus b) Beinkrämpfe, Gliederschmerzen |
|
2004 |
2 |
a) Hautausschläge b) Churg Strauss Syndrom
(zweiter gemeldeter Verursacher: Singulair) |
|
2005 |
1 |
Schweißausbruch,
Dyspnoe |
Seit
dem Jahr 2000 ist beim BMGF folgende österreichische Meldung über
Arzneimittelnebenwirkungen eingelangt, bei der eine Formoterol haltige
Arzneispezialität als Verursacher angegeben wurde:
|
Jahr |
Zahl
der Meldungen |
|
|
2000 |
1 |
Tachkardie,
Herzrhythmusstörungen, trockener
Mund, Schüttelfrost (zweiter
gemeldeter Verursacher: Avelox) |
Die
Meldungen wurden dokumentiert und fachlich beurteilt; Sofortmaßnahmen waren
aufgrund der gemeldeten Sachverhalte nicht erforderlich.
Fragen 5 und 6:
Grundsätzlich
werden alle österreichischen Meldungen über unerwünschte Arzneimittelwirkungen
dem Ausschuss für Arzneimittelsicherheit (Unterausschuss des
Arzneimittelbeirates) vorgelegt; dies erfolgte auch in den oben genannten
Fällen. Der Ausschuss für Arzneimittelsicherheit hat keine Stellungnahme zu
diesen Fällen abgegeben.
Frage 7:
Der Hauptverband der österreichischen Sozialversicherungsträger gab
dazu folgende Stellungnahme ab:
„Grundsätzlich werden die Kosten seitens der sozialen
Krankenversicherung für LABA-hältige Arzneispezialitäten nur unter nachstehend
angeführten Voraussetzungen übernommen:
|
Bezeichnung der
Arzneispezialität |
Voraussetzung für die
Kostenübernahme im Gelben Bereich |
Voraussetzung für die
Kostenübernahme im Grünen Bereich ohne vorherige Genehmigung |
|
Foradil
Dosieraerosol |
|
Mittelschweres
bis schweres Asthma mit nächtlichen Anfällen; stabile mittelgradige bis
schwere COPD |
|
Foradil Dosieraerosol 9,2 g |
Eine
Kostenübernahme ist möglich, wenn Therapiealternativen (Packungsgrößen) des
grünen Bereiches zur Abdeckung des individuellen Monatsbedarfes nicht
ausreichen. |
|
|
Foradil
Kaps. z. Trockeninh. |
|
Mittelschweres
bis schweres Asthma mit nächtlichen Anfällen; stabile mittelgradige bis
schwere COPD |
|
Oxis
Turbohaler 12 mcg Dosier-Pulverinhalator |
|
Mittelschweres
bis schweres Asthma mit nächtlichen Anfällen; stabile mittelgradige bis
schwere COPD |
|
Oxis
Turbohaler 6 mcg Dosier-Pulverinhalator |
|
leichtes
bis mittelschweres Asthma mit nächtlichen Anfällen |
|
Seretide
Diskus forte 0,05 mg/0,5 mg Plv. z. Inh. |
|
Mittelschweres
bis schweres Asthma mit nächtlichen Anfällen; Patienten mit COPD Stadium III
und IV und wiederholten Exazerbationen (mehr als 1x pro Jahr) nach
Erstverordnung durch Pulmologen |
|
Seretide
Diskus junior 0,05 mg/0,1 mg Plv. z. Inh. |
|
mittelschweres
Asthma mit nächtlichen Anfällen |
|
Seretide
Diskus standard 0,05 mg/0,25 mg Plv. z. Inh. |
|
mittelschweres
bis schweres Asthma mit nächtlichen Anfällen |
|
Seretide forte 25/250 mcg/Sprühstoß Dosieraerosol |
Eine
Kostenübernahme ist nur möglich, wenn mit Therapiealternativen
(Darreichungsformen) aus dem grünen Bereich nachweislich nicht das Auslangen
gefunden werden kann. |
|
|
Seretide
junior 25/50 mcg/Sprühstoß Dosieraerosol |
|
Mittelschweres
Asthma mit nächtlichen Anfällen |
|
Seretide
standard 25/125 mcg/Sprühstoß Dosieraerosol |
|
Mittelschweres
bis schweres Asthma mit nächtlichen Anfällen |
|
Serevent
Diskus Pulver z. Trockeninh. |
|
Mittelschweres
bis schweres Asthma mit nächtlichen Anfällen; stabile mittelgradige bis
schwere COPD |
|
Serevent
Dosieraerosol |
|
Mittelschweres
bis schweres Asthma mit nächtlichen Anfällen; stabile mittelgradige bis
schwere COPD |
|
Serevent Rotadisks Pulver z. Trockeninh. |
|
Mittelschweres
bis schweres Asthma mit nächtlichen Anfällen; stabile mittelgradige bis
schwere COPD |
|
Symbicort
forte Turbohaler Dosier-Pulverinhalator |
Eine
Kostenübernahme ist nur möglich, wenn mit Therapiealternativen
(Darreichungsformen) aus dem grünen Bereich nachweislich nicht das Auslangen
gefunden werden kann. |
|
|
Symbicort
mite Turbohaler Dosier-Pulverinhalator |
|
mittelschweres
Asthma mit nächtlichen Anfällen |
|
Symbicort
Turbohaler Dosier-Pulverinhalator |
|
Mittelschweres
bis schweres Asthma mit nächtlichen Anfällen; Patienten mit COPD Stadium III
und IV und wiederholten Exazerbationen (mehr als 1x pro Jahr) nach
Erstverordnung durch Pulmologen |
Wie
aus der Tabelle ersichtlich, sind für LABA-hältige Arzneispezialitäten im
Erstattungskodex durchwegs Einschränkungen vorgesehen.
Die
Nutzen-Risiko-Bewertung durch den Hauptverband bzw. durch dessen beratendes
Fachgremium ist bereits eine vorsichtige; durch die Indikationseinschränkung
ist ein besonders sorgfältiger Umgang mit diesen Substanzen seitens der
sozialen Krankenversicherung gewährleistet.“
Frage 8:
Der Hauptverband der österreichischen Sozialversicherungsträger gab
dazu folgende Stellungnahme ab:
„Der Hauptverband bedauert, ebenso wie der Autor des Leitartikels im New England Journal of Medicine (353(25):2637-2639: Safety of Long-Acting Beta-Agonists — An Urgent Need to Clear the Air, Fernando D. Martinez, M.D.) dass die Hersteller keine definitiven Untersuchungen zur Sicherheit dieser Mittel bei korrekter Anwendung vorgelegt haben, zumal diese Wirkstoffe schon recht lange am Markt sind.
Wir werden die Warnung der FDA zum Anlass nehmen, um diese Gruppe der Arzneispezialitäten erneut einer Überprüfung zu unterziehen.“
Frage 9:
Der
Oberste Sanitätsrat wurde mit dieser Thematik nicht befasst, zumal die
Beurteilung von Medikamenten und allfällige Warnhinweise in die Zuständigkeit
des Arzneimittelbeirates fallen.
Frage 10:
Zu
dieser Frage habe ich die Österreichische Ärztekammerkammer befasst. Mit
Schreiben vom 19.1.2006 hat die Österreichische Ärztekammer mitgeteilt, dass
das „Asthmamedikament“ „Advair“ nicht zugelassen und daher nicht im Handel
verwendet werde. Zu den Medikamenten „Serevent“ und „Foradil“ wird
festgehalten, dass anwendende Ärzte über besondere Verwendungsempfehlungen
informiert worden sind und im übrigen für diese beiden Medikamente keine
Zwischenfälle erwartet werden, sodass weitere Maßnahmen nicht erforderlich
seien. Für nähere Informationen darf ich die Stellungnahme der Österreichischen
Ärztekammer samt Beilagen meiner Beantwortung anschließen.
Fragen 11, 12 und 13:
Die
Daten einer US-amerikanischen Studie zu Salmeterol („SMART-study“) und die
daraus resultierenden Veröffentlichungen der FDA (publiziert am 18. November
2005) werden seit November 2005 von den nationalen Experten in den zuständigen
Fachgremien der EU eingehend diskutiert. Diese Diskussion ist derzeit noch
nicht abgeschlossen.
Mit freundlichen Grüßen
Maria Rauch-Kallat
Bundesministerin
Anmerkung der Parlamentsdirektion:
Die
vom Bundesministerium übermittelte Anlagen stehen nur als Image zur Verfügung.