3600/AB XXIV. GP
Eingelangt am 11.01.2010
Dieser Text wurde elektronisch übermittelt. Abweichungen vom Original sind
möglich.
BM für Gesundheit
Anfragebeantwortung

|
Frau Präsidentin des Nationalrates Maga. Barbara Prammer Parlament 1017 Wien |
Alois Stöger diplômé Bundesminister
|
Wien, am 7.Jänner 2010
GZ: BMG-11001/0339-I/5/2009
Sehr geehrte Frau Präsidentin!
Ich beantworte die an mich gerichtete schriftliche parlamentarische Anfrage Nr. 3633/J der Abgeordneten Dr. Belakowitsch-Jenewein und weiterer Kollegen nach den mir vorliegenden Informationen wie folgt:
Frage 1:
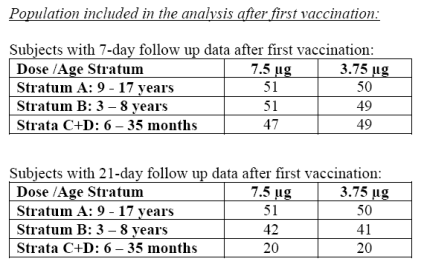
Bisher wurde der Impfstoff an 297 Kindern und Jugendlichen getestet. Davon waren 96 Kinder zwischen 6 und 35 Monaten, 100 Kinder zwischen 3 und 8 Jahren und 101 Kinder und Jugendliche zwischen 9 und 17 Jahren alt. Es steht nur die Aufschlüsselung in diese Altersgruppen zur Verfügung.
Fragen 2 bis 5:
In der angeführten Studie sind nur gesunde Kinder und Jugendliche eingeschlossen.
Fragen 6 und 7:
Es steht nur eine Aufschlüsselung in die unter Frage 1 angeführten Altersgruppen zur Verfügung.
Frage 8:
Wie alle Impfstoffe wurde auch Celvapan nicht an schwangeren Frauen getestet. Da Celvapan weder Adjuvantien (Wirkungsverstärker), noch Konservierungsmittel enthält, ist eine gute Verträglichkeit sowohl bei Schwangeren als auch bei Nichtschwangeren zu erwarten.
Frage 9:
Die Studien zu Influenza A(H1N1) an Kindern und Erwachsenen laufen noch. Die Ergebnisse werden aber laufend von den Zulassungsbehörden analysiert und bewertet.
Die Studien zu Influenza A(H5N1, Vogelgrippe) an Erwachsenen sind abgeschlossen und wurden im Rahmen des zentralen Zulassungsverfahrens von Celvapan bewertet.
Frage 10:
Die Auswertung der Sicherheitsdaten aus den H5N1 sowie den H1N1 Studien zeigt ein sehr gutes, der saisonalen Influenza-Impfung vergleichbares Sicherheitsprofil. In den H1N1 Studien berichten ca. 15 %, in den H5N1 Studien ca. 23 % der Probandinnen und Probanden über kurz anhaltende systemische Nebenwirkungen (z.B. Kopfweh, Schwitzen, Müdigkeit, Fieber). In allen Studien war die Fieberrate bei ca. 2%.
Lokalreaktionen wie Schmerzen, Schwellung oder Rötung an der Einstichstelle wurden in den H1N1 Studien von ca. 8% der Erwachsenen und von 7-16% der Kinder angegeben, in den H5N1 Studien von ca. 8-16% der Probandinnen und Probanden
Frage 11:
Im Rahmen einer Influenza-Pandemie ist die höchste Morbidität und Mortalität für Kinder, und hier wiederum für die jüngeren Kinder zu erwarten. Daher gibt es auch eine Impfempfehlung des ECDC besonders für Kinder unter 2 Jahren. Mit Celvapan gab es im Mock-up Dossier keine Studien mit Kindern.
Da die Influenzaimpfung seit Jahrzehnten etabliert ist, kann man auf die zur Verfügung stehende Evidenz mit saisonalen Ganzvirusimpfstoffen an Kindern zurückgreifen, die immunogen und verträglich waren. Dabei ist zu beachten, dass die saisonalen Influenzaimpfstoffe trivalent (zwei Influenza A und ein Influenza B Stamm) waren, Celvapan aber monovalent ist (nur ein Influenza A Stamm enthalten) und daher eine bessere Verträglichkeit zu erwarten ist.
Ich möchte auch darauf hinzuweisen, dass diesbezügliche nationale Impf-empfehlungen auch vom Impfausschuss abgegeben wurden.
Frage 12:
Mit Stand 14.12.2009 wurden im elektronischen Melderegister 1360 Kinder in der Altersgruppe 0-14 Jahren als an Influenza A(H1N1) erkrankt gemeldet.