11290/J XXVII. GP
Eingelangt am 15.06.2022
Dieser Text wurde elektronisch übermittelt. Abweichungen vom Original sind
möglich.
ANFRAGE
des Abgeordneten Mag. Gerald Hauser
und weiterer Abgeordneter
an den Bundesminister für Soziales, Gesundheit, Pflege und Konsumentenschutz
betreffend aktuelle wissenschaftliche Artikel und Studien berichten von einer erheblichen Toxizität kationischer Lipide, wie z.B. ALC-0315, aber auch PEGylierter Lipide, wie z.B. ALC-0159, welche als Komponente des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty verwendet werden
Das Bundesministerium hat in den Anfragebeantwortungen auf unsere Anfragen zu den COVID-19 mRNA-Impfstoffen und deren medizinischen Hilfsstoffen, auf den EMA Assessment Report Comirnaty (19.02.2021) verwiesen, daher wurden die Angaben der EMA zum Pfizer/BioNTech COVID-19 Impfstoff Comirnaty und zu den, im Fertigprodukt enthaltenen pharmazeutischen Hilfsstoffen ALC-0315 und ALC-0159, im EMA Assessment Report Comirnaty (19.02.2021)[1], aber auch Angaben aus weiteren Dokumenten von z.B. der EMA und der WHO, in die detaillierte Gestaltung unserer Fragen integriert.
Aus dem wissenschaftlichen Artikel von R. Tenchov, R. et al. (Juni 2021): „Lipid Nanoparticles—From Liposomes to mRNA Vaccine Delivery, a Landscape of Research Diversity and Advancement” ACS Nano, DOI: 10.1021/acsnano.1c04996.“ (16988) geht hervor: „Toxicity of Lipids Used in LNP Formulations. Since LNPs are mainly composed of natural lipids, they have been considered pharmacologically inactive and minimally toxic. However, in some cases, LNPs are not immunologically inert131 while LNP constituents are unnatural compounds which may be toxic to human cells.132 For example, while cationic lipids offer great promise as carriers for the delivery of fragile compounds such as nucleic acids, some cationic lipids cause cytotoxicity.133 In some cases, cationic lipids reduce mitosis in cells, form vacuoles in the cytoplasms of cells, and cause detrimental effects on key cellular proteins such as protein kinase C.134 The cytotoxicity of cationic lipids depends on the structures of their hydrophilic head groups; amphiphiles with quaternary ammonium head groups are more toxic than those with tertiary amine head groups.134 The effect of the hydrophobic chains on the toxicity of lipids is not well studied, hindering the design of less toxic lipids.“[2]
Laut Angaben R. Tenchov et al. (Juni 2021) können kationische Lipide, wie ALC-0315, die Mitose in Zellen reduzieren. Durch Mitosegifte kann der Teilungsvorgang von Zellen beeinflusst werden. Chemische Substanzen verhindern den regulären Ablauf der Mitose. Sie blockieren den Spindelapparat und bewirken, dass die Chromosomen nicht getrennt werden und somit die Verteilung auf die Tochterzellen gehemmt wird. Die Folge sind polyploide Zellkerne, in denen ein vielfacher Chromosomensatz vorliegt, z. B. ein dreifacher oder ein vierfacher Chromosomensatz. Für den Menschen ist Polyploidie tödlich. Neugeborene, die aufgrund einer fehlerhaften Zellteilung im frühen Entwicklungsstadium oder wegen eines defekten Spermiums oder Eizelle mit dreifachem Chromosomensatz (Triploidie) zur Welt kommen, sterben meist bei der Geburt oder werden tot geboren. Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben R. Tenchov et al. (Juni 2021) mit Bezug auf die Reduktion der Mitose durch kationische Lipide, wie ALC-0315, im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass das kationische Lipid ALC-0315, mit Bezug auf die Zellteilung beim Menschen, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden keinerlei schädigende Wirkung hat?
Laut Angaben R. Tenchov et al. (Juni 2021) können kationische Lipide, wie ALC-0315, schädliche Auswirkungen auf zelluläre Schlüsselproteine haben. Membranproteine sind funktionelle Schlüsselproteine, da sie zum einen, ein wichtiger Bestandteil der strukturellen Abgrenzung der Organellen sind; weiterhin spielen sie eine entscheidende Rolle bei nahezu allen zellulären Funktionen. Zu nennen sind hier neben anderen: z.B. Transport: (Proteine, Ionen), Enzymaktivität, Signalübertragung, Zellverbindung, Zell-Zell-Erkennung usw. Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben von R. Tenchov et al. (Juni 2021) mit Bezug auf die schädlichen Auswirkungen von kationischen Lipiden, wie ALC-0315, im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, auf zelluläre Schlüsselproteine?
Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass das kationische Lipid ALC-0315 mit Bezug auf zelluläre Schlüsselproteine, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen, keinerlei dauerhaft schädigende Wirkung hat?
Laut Angaben R. Tenchov et al. (Juni 2021) hängt die Zytotoxizität kationischer Lipide von den Strukturen ihrer hydrophilen Kopfgruppen ab, laut R. Tenchov et al. (Juni 2021) sind Lipidnanopartikel mit quaternären Ammonium-Kopfgruppen toxischer als solche mit tertiären Amin-Kopfgruppen. ALC-0315 ist ein tertiäres Amin und ist daher, laut Tenchov R. et al. (Juni 2021), nur weniger toxisch. Laut Tenchov R. et al. (Juni 2021) ist die Auswirkung der hydrophoben Ketten auf die Toxizität von Lipiden ist nicht gut untersucht, was die Entwicklung weniger toxischer Lipide behindert. Wie lautet die Stellungnahme des Bundesministeriums zu diesen Angaben von R. Tenchov et al. (Juni 2021) mit Bezug auf das kationische Lipid ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus der Studie von Aleisha R. Brock et al. (Oktober 2021): „Spontaneous Abortions and Policies on COVID-19 mRNA Vaccine Use During Pregnancy“ (Seite 1) geht hervor: „Abstract: The use of mRNA vaccines in pregnancy is now generally considered safe for protection against COVID-19 in countries such as New Zealand, USA, and Australia. However, the influential CDCsponsored article by Shimabukuro et al. (2021) used to support this idea, on closer inspection, provides little assurance, particularly for those exposed in early pregnancy. The study presents falsely reassuring statistics related to the risk of spontaneous abortion in early pregnancy, since the majority of women in the calculation were exposed to the mRNA product after the outcome period was defined (20 weeks’ gestation). In this article, we draw attention to these errors and recalculate the risk of this outcome based on the cohort that was exposed to the vaccine before 20 weeks’ gestation. Our re-analysis indicates a cumulative incidence of spontaneous abortion 7 to 8 times higher than the original authors’ results (p < 0.001) and the typical average for pregnancy loss during this time period. In light of these findings, key policy decisions have been made using unreliable and questionable data. We conclude that the claims made using these data on the safety of exposure of women in early pregnancy to mRNA-based vaccines to prevent COVID-19 are unwarranted and recommend that those policy decisions be revisited“[3]
4:
Laut Angaben Aleisha R. Brock et al. (Oktober 2021) ist das Risiko für schwangere Personen, nach der Verabreichung eines COVID-19 mRNA Impfstoffs, in den ersten 20 Schwangerschaftswochen einen Spontanabortus zu erleiden, um 7- bis 8-mal höher als die Ergebnisse, die in einem, von den CDC finanzierten, wissenschaftlichen Artikel von Shimabukuro et al. angegeben werden. Wie lautet die Stellungnahme des Bundesministeriums zu diesen Angaben von Aleisha R. Brock et al. (Oktober 2021) mit Bezug auf den Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus der Broschüre des Sozialministeriums Die Impfung schützt. geht hervor: „Für Paare mit Kinderwunsch, Schwangere und Stillende ist es besonders wichtig, sich gegen COVID-19 impfen zu lassen. Die Impfung der Eltern schützt auch Kinder vor einer Ansteckung. Alle EU-weit zugelassenen COVID-19-Impfstoffe • sind sicher und wirksam. • wurden umfangreich getestet, auch an Menschen mit Kinderwunsch. Das Nationale Impfgremium empfiehlt Schwangeren, Stillenden und Menschen mit Kinderwunsch die Corona-Schutzimpfung, • weil sie ein umfassender Schutz für Eltern und Kind ist. • weil sie vor schweren Krankheitsverläufen, Todesfällen und Langzeitfolgen schützt.“[4]
5:
Wie lautet die Stellungnahme des Bundesministeriums, zur Bedrohung von ungeborenem Leben durch mRNA-Impfstoffe und kationische Lipide laut Aussagen von R. Tenchov et al. (Juni 2021) und Aleisha R. Brock et al. (Oktober 2021) mit Bezug auf die Empfehlung in der Broschüre des Sozialministeriums, zur Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty an Personen mit Kinderwunsch, Schwangere und Stillende?
Aus der EMA Produktinformation Comirnaty geht hervor (Seite 28): „4.6 Fertilität, Schwangerschaft und Stillzeit - Schwangerschaft: Eine große Menge von Beobachtungsdaten von schwangeren Frauen, die während des zweiten und dritten Trimenons mit Comirnaty geimpft wurden, hat keine Zunahme unerwünschter Schwangerschaftsausgänge gezeigt. Zwar liegen derzeit nur wenige Daten zum Schwangerschaftsausgang nach einer Impfung im ersten Trimenon vor, jedoch wurde kein erhöhtes Risiko für eine Fehlgeburt beobachtet. Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Wirkungen in Bezug auf Schwangerschaft, embryonale/fötale Entwicklung, Geburt oder postnatale Entwicklung schließen (siehe Abschnitt 5.3). Comirnaty kann während der Schwangerschaft verwendet werden.“[5]
6:
Laut Angaben Aleisha R. Brock et al. (Oktober 2021) ist das Risiko von schwangeren Personen, nach der Verabreichung eines COVID-19 mRNA Impfstoffs, in den ersten 20 Schwangerschaftswochen einen Spontanabortus zu erleiden, um 7- bis 8-mal höher, als die Ergebnisse, die in einem, von den CDC finanzierten, wissenschaftlichen Artikel von Shimabukuro et al. angegeben werden. Pfizer/BioNTech gibt jedoch in der Produktinformation Comirnaty an: „Zwar liegen derzeit nur wenige Daten zum Schwangerschaftsausgang nach einer Impfung im ersten Trimenon vor, jedoch wurde kein erhöhtes Risiko für eine Fehlgeburt beobachtet.“ Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
7:
In den USA wurden mit Datenstand 20.05.2022, in zeitlicher Nähe zu Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs, in Summe 597 Fehlgeburten an die VAERS-Datenbank der CDC gemeldet. Aus der Studie Electronic Support for Public Health–Vaccine Adverse Event Reporting System (ESP:VAERS), die von Harvard Pilgrim Health Care, Inc. (2011) in den USA durchgeführt wurde, geht hervor (Seite 6): „Unerwünschte Ereignisse bei Arzneimitteln und Impfstoffen sind häufig, werden aber zu selten gemeldet. Obwohl 25 % der ambulanten Patienten von einem unerwünschten Arzneimittelereignis betroffen sind, werden weniger als 0,3 % aller unerwünschten Arzneimittelereignisse und 1-13 % der schwerwiegenden Ereignisse an die Food and Drug Administration (FDA) gemeldet. Ebenso werden weniger als 1 % der unerwünschten Wirkungen von Impfstoffen gemeldet.“ Nur ca. 1% der unerwünschten Nebenwirkungen von Impfstoffen werden in den USA gemeldet, aus den Zahlen zu den, in den USA an die VAERS-Datenbank gemeldeten Fehlgeburten, in zeitlicher Nähe zur Impfung mit dem COVID-19 Impfstoff von Pfizer/BioNTech und der hohen Dunkelziffer, an nicht gemeldeten unerwünschten Nebenwirkungen, geht somit hervor, dass die Bedrohung von ungeborenem Leben durch den Pfizer/BioNTech COVID-19 gegeben und real ist. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Aus dem wissenschaftlichen Artikel von Xucheng Hou et al. (Dezember 2021): „Lipid nanoparticles for mRNA delivery“, der von Tal Zaks, der während der Entwicklung des Moderna COVID-19 Impfstoffs mRNA-1273 Chief Medical Officer von Moderna war und Moderna Mitbegründer Robert Langer mitverfasst wurde, (1087) geht hervor: „Safety profiles. The safety profile of lipid nanoparticle–mRNA formulations correlates with the lipid components and mRNA molecules. Lipid components may activate host immune responses following systemic or local administration; for example, PEG-lipids could induce hypersensitivity reactions by stimulating the complement system127,169. Moreover, anti-PEG antibodies could result in fast systemic clearance of subsequently administered PEGylated nanoparticles by accelerated blood clearance127,169. The accelerated blood clearance phenomenon may change the bioavailability and biodistribution of the drug encapsulated in PEGylated nanoparticles and, thus, cause side effects127,169. To ameliorate safety concerns, numerous natural and synthetic polymers have been investigated as alternatives to PEG, of which several are under evaluation in clinical trials127,169. Cationic and ionizable lipids have also been reported to stimulate the secretion of pro-inflammatory cytokines and reactive oxygen species170–173. Although the immunogenicity of these lipids has not yet been fully understood, complement system and Toll-like receptors may participate in innate immune activation170,173–175. Cytotoxicity of lipid materials is also a safety concern, depending on the dose, lipid properties and cell types176,177. In vivo application of lipid nanoparticles has been reported to induce liver and lung injuries in rodents170,173, which may be attributed to the cytotoxicity of the materials and the induction of pro-inflammatory factors171,178.“ [6]
8:
Laut Angaben Xucheng Hou et al. (Dezember 2021), können Lipidkomponenten nach systemischer oder lokaler Verabreichung Immunreaktionen des Wirtes auslösen, so könnten PEG-Lipide durch Stimulierung des Komplementsystems Überempfindlichkeitsreaktionen hervorrufen. Darüber hinaus könnten Anti-PEG-Antikörper zu einer schnellen systemischen Clearance von, mit dem mRNA-Impfstoff verabreichten PEGylierten Nanopartikeln, durch eine beschleunigte Blut-Clearance führen. Das Phänomen der beschleunigten Blutausscheidung kann die Bioverfügbarkeit und die Biodistribution, des in PEGylierten Nanopartikeln verkapselten Arzneimittels, verändern und somit Nebenwirkungen verursachen. Wie lautet die Stellungnahme des Bundesministeriums zu diesen Angaben von Xucheng Hou et al. (Dezember 2021) mit Bezug auf das PEGylierte Lipid ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
8 a.:
Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass das PEGylierte Lipid ALC-0159, im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, mit Bezug auf Anti-PEG-Antikörper, die durch die Aufnahme von PEG-haltigen Lebensmitteln in der Vergangenheit oder durch eine, in der Vergangenheit bereits verabreichte Dosis an Pfizer/BioNTech Comirnaty COVID-19 Impfstoff, vom Organismus bereits gebildet wurden, nicht zu einer schnellen systemischen Clearance durch eine beschleunigte Blut-Clearance führen und dass das Phänomen der beschleunigten Blutausscheidung, die Bioverfügbarkeit und die Biodistribution, des in PEGylierten Nanopartikeln verkapselten Arzneimittels - Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, dadurch nicht verändert wird und somit keine schweren oder tödlichen Nebenwirkungen, nach der Verabreichung von Pfizer/BioNTech Comirnaty, aufgrund von bereits im Organismus vorhandenen Anti-PEG-Antikörpern, verursacht werden? (Bitte um Übermittlung der Unterlagen)
9:
Laut Angaben Xucheng Hou et al. (Dezember 2021) ist die Zytotoxizität von Lipidmaterialien ein Sicherheitsproblem, das von der Dosis, den Lipideigenschaften und den Zelltypen abhängt. Im menschlichen Organismus gibt es mehr als 200 verschiedene Zelltypen, von denen jeder darauf spezialisiert ist, eine bestimmte Funktion zu erfüllen oder ein spezialisiertes Gewebe zu bilden. Die wichtigsten Zelltypen im menschlichen Körper sind: Stammzellen, Rote Blutzellen (Erythrozyten), Weiße Blutzellen (Leukozyten), Blutplättchen (Thrombozyten), Nervenzellen (Neurone), Gliazellen, Muskelzellen (Myozyten), Knorpelzellen (Chondrozyten), Knochenzellen, Hautzellen, Endothelzellen, Epithelzellen, Fettzellen (Adipozyten), Keimzellen (Gameten). Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben über die Zytotoxizität von Lipidmaterialien, von Xucheng Hou et al. (Dezember 2021), mit Bezug auf das kationische Lipid ALC-0315 im Pfizer/BioNTech Impfstoff Comirnaty?
9 a.:
Die Zytotoxizität von Lipidmaterialien ist, laut Angaben Xucheng Hou et al. (Dezember 2021), ein Sicherheitsproblem, das von der Dosis, den Lipideigenschaften und den Zelltypen abhängt. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die die Zytotoxizität, die durch Lipidmaterialen, wie z.B. ALC-0315, verursacht wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, keine dauerhaft schädigende oder lebensbedrohende Auswirkung auf die verschiedenen Zelltypen des menschlichen Organismus hat?
Aus dem wissenschaftlichen Artikel von Xucheng Hou et al. (Dezember 2021): „Lipid nanoparticles for mRNA delivery“, der von Tal Zaks, der während der Entwicklung des Moderna COVID-19 Impfstoffs mRNA-1273 Chief Medical Officer von Moderna war und Moderna Mitbegründer Robert Langer mitverfasst wurde, (1087) geht hervor: „…Cationic and ionizable lipids have also been reported to stimulate the secretion of pro-inflammatory cytokines and reactive oxygen species 170–173“
Aus der wissenschaftlichen Arbeit von Robert J. Dunlop et al. (2000): „Cytokines and Advanced Cancer“ (Seite 1) geht hervor: „Abstract: Cytokines have a major role in promoting the growth and spread of cancers. Elevated levels of several cytokines have been described in cancer patients. Evidence from animal and human studies suggests that cytokines may contribute to a wide range of symptoms in advanced cancer, including: asthenia, pain, drowsiness, cognitive failure, agitated delirium, autonomic dysfunction, anorexia, cachexia, fever and metabolic abnormalities. Considerable effort is being directed at finding anticytokine treatments, raising the possibility of new options for symptoms that are currently difficult to control. J Pain Symptom Manage 2000; 20:214–232. © U.S. Cancer Pain Relief Committee, 2000)[7]
10:
Laut Angaben Xucheng Hou et al. (Dezember 2021) stimulieren kationische Lipide, wie ALC-0315, im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, die Sekretion von entzündungsfördernden Zytokinen. Laut Angaben Robert J. Dunlop et. al. (2000) spielen Zytokine eine wichtige Rolle bei der Förderung, dem Wachstum und der Ausbreitung von Krebserkrankungen. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden zum neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben von Xucheng Hou et al. (Dezember 2021) zur Stimulation der Sekretion von entzündungsfördernden Zytokinen, die durch kationische Lipide, wie ALC-0315, verursacht wird und die, laut Robert J. Dunlop et al. (2000), eine wichtige Rolle bei der Förderung, dem Wachstum und der Ausbreitung von Krebserkrankungen spielt, mit Bezug auf das kationische Lipid ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
10 a.:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden zum neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von entzündungsfördernden Zytokinen, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zur Entstehung von Tumoren im Organismus führt?
Aus dem wissenschaftlichen Artikel von Xucheng Hou et al. (Dezember 2021): Lipid nanoparticles for mRNA delivery, der von Tal Zaks, der während der Entwicklung des Moderna COVID-19 Impfstoffs mRNA-1273 Chief Medical Officer von Moderna war und Moderna Mitbegründer Robert Langer mitverfasst wurde, (1087) geht hervor: „…Cationic and ionizable lipids have also been reported to stimulate the secretion of pro-inflammatory cytokines and reactive oxygen species170–173“[8]
Aus der wissenschaftlichen Arbeit von Michael Schieber et al. (2014): ROS Function in Redox Signaling and Oxidative Stress (Seite1) geht hervor: „Abstract: Oxidative stress refers to elevated intracellular levels of reactive oxygen species (ROS) that cause damage to lipids, proteins and DNA. Oxidative stress has been linked to a myriad of pathologies. However, elevated ROS are also signaling molecules i.e. redox biology that maintain physiological functions. In this review we discuss the two faces of ROS, redox signaling and oxidative stress, and their contribution to both physiological and pathological conditions. Redox biology refers to low levels of ROS that activate signaling pathways to initiate biological processes while oxidative stress denotes high levels of ROS that incur damage to DNA, protein or lipids. Thus, the response to ROS displays hormesis. The In this review, we argue that redox biology, rather than oxidative stress, underlies physiological and pathological conditions.“[9]
Aus der wissenschaftlichen Arbeit von Mehdi Sharifi-Rad et al. (2020) geht hevor: „Lifestyle, Oxidative Stress, and Antioxidants: Back and Forth in the Pathophysiology of Chronic Diseases“ (Seite1) geht hervor: „Oxidative stress plays an essential role in the pathogenesis of chronic diseases such as cardiovascular diseases, diabetes, neurodegenerative diseases, and cancer. Long term exposure to increased levels of pro-oxidant factors can cause structural defects at a mitochondrial DNA level, as well as functional alteration of several enzymes and cellular structures leading to aberrations in gene expression.“[10]
11:
Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff, die Sekretion von reaktiven Sauerstoffspezies stimulieren. Laut Angaben Michael Schieber et al. (2014) entsteht oxidativer Stress aus einem erhöhten Spiegel an reaktiven Sauerstoffspezies innerhalb der menschlichen Zellen. Laut Angaben Mehdi Sharifi-Rad et al. (2020) spielt oxidativer Stress eine wesentliche Rolle bei der Entstehung chronischer Krankheiten wie Krebs, Herz-Kreislauf-Erkrankungen, Diabetes und neurodegenerativen Erkrankungen. Eine langfristige Exposition gegenüber erhöhten Konzentrationen von pro-oxidativen Faktoren kann zu strukturellen Defekten auf der Ebene der mitochondrialen DNA führen, sowie funktionelle Veränderungen verschiedener Enzyme und zellulärer Strukturen verursachen, die zu Abweichungen in der Genexpression führen. Defekte der Mitochondrien führen zum Versagen des zellulären Energiestoffwechsels. Oxidativer Stress soll auch dem zentralen Nervensystem schaden und zu Krankheiten wie Schlaganfall, Parkinson oder Alzheimer führen können. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Wie lautet die Stellungnahme des Bundesministeriums den Angaben von Xucheng Hou et al. (Dezember 2021) zur Stimulation der Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide verursacht wird, zu den Angaben von Michael Schieber et al. (2014) wonach oxidativer Stress aus einem erhöhten Spiegel an reaktiven Sauerstoffspezies innerhalb der menschlichen Zellen entsteht, der laut Mehdi Sharifi-Rad et al. (2020) eine wesentliche Rolle bei der Entstehung chronischer Krankheiten, wie z.B. Krebs, Herz-Kreislauf-Erkrankungen, Diabetes und neurodegenerativen Erkrankungen spielt, mit Bezug auf das kationische Lipid ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten, 50,55, 56) wurden zum neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315 keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der die Entstehung von Tumoren im Organismus verursachen kann? (Bitte um Übermittlung der Unterlagen)
11 b.:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der Herz-Kreislauferkrankungen verursachen kann?
11 c.:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der Diabetes verursachen kann?
11 d.:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der neurodegenerative Erkrankungen verursachen kann?
11 e.:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der strukturelle Defekte auf der Ebene der mitochondrialen DNA verursachen kann?
11 f.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der funktionelle Veränderungen verschiedener Enzyme und zellulärer Strukturen, die zu Abweichungen in der Genexpression führen, verursachen kann?
Aus dem wissenschaftlichen Artikel von Xucheng Hou et al. (Dezember 2021): „Lipid nanoparticles for mRNA delivery“, der von Tal Zaks, der während der Entwicklung des Moderna COVID-19 Impfstoffs mRNA-1273 Chief Medical Officer von Moderna war und Moderna Mitbegründer Robert Langer mitverfasst wurde, (1087) geht hervor: „…Cationic and ionizable lipids have also been reported to stimulate the secretion of pro-inflammatory cytokines and reactive oxygen species170–173“
Aus der Studie Zhongjie Yu et al. (Mai 2020): „Reactive Oxygen Species-Related Nanoparticle Toxicity in the Biomedical Field“ (Seite 1) geht hervor: „Abstract: The unique physicochemical characteristics of nanoparticles have recently gained increasing attention in a diverse set of applications, particularly in the biomedical field. However, concerns about the potential toxicological effects of nanoparticles remain, as they have a higher tendency to generate excessive amounts of reactive oxygen species (ROS). Due to the strong oxidation potential, the excess ROS induced by nanoparticles can result in the damage of biomolecules and organelle structures and lead to protein oxidative carbonylation, lipid peroxidation, DNA/RNA breakage, and membrane structure destruction, which further cause necrosis, apoptosis, or even mutagenesis. This review aims to give a summary of the mechanisms and responsible for ROS generation by nanoparticles at the cellular level and provide insights into the mechanics of ROS-mediated biotoxicity. We summarize the literature on nanoparticle toxicity and suggest strategies to optimize nanoparticles for biomedical applications. Keywords: Reactive oxygen species, Nanoparticles, Oxidative stress, Biotoxicity“[11]
12:
Laut Angaben Xucheng Hou et al. (Dezember 2021) stimulieren kationische Lipide, wie ALC-0315, die Sekretion von reaktiven Sauerstoffspezies. Laut Angaben Zhongjie Yu et al. (Mai 2020) bestehen nach wie vor Bedenken hinsichtlich der potenziellen toxikologischen Auswirkungen von Nanopartikeln, da sie eher dazu neigen, übermäßige Mengen an reaktiven Sauerstoffspezies (ROS) zu erzeugen. Aufgrund des starken Oxidationspotenzials können die von Nanopartikeln induzierten überschüssigen ROS zur Schädigung von Biomolekülen und Organellstrukturen führen und eine oxidative Carbonylierung von Proteinen, Lipidperoxidation, DNA/RNA-Bruch und die Zerstörung von Membranstrukturen bewirken, die wiederum Nekrose, Apoptose oder sogar Mutagenese verursachen. Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben laut Zhongjie Yu et al. (Mai 2020) mit Bezug das kationische Lipid ALC-0315 im Pfizer/BioNTech Impfstoff Comirnaty?
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden zum neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 liegen nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die übermäßigen Mengen von reaktiven Sauerstoffspezies ,die durch kationische Lipide, wie ALC-0315, erzeugt werden, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, keinerlei gesundheits- und lebensbedrohende Schädigungen von Biomolekülen und Organellenstrukturen verursachen und keinerlei gesundheits- und lebensbedrohende Schädigungen durch oxidative Carbonylierung von Proteinen, Lipidperoxidation und keine gesundheits- und lebensbedrohenden DNA/RNA-Brüche verursachen, die die Zerstörung von Membranstrukturen bewirken, die sogar Mutagenese verursachen kann?
13: Aus einem Schriftstück der Karl Landsteiner Privatuniversität für Gesundheitswissenschaften (V 160222) geht hervor: „Die Datenlage zu Symptomen wie Müdigkeit, Abgeschlagenheit, Konzentrationsschwäche und Schlafstörungen oder anderen unspezifischen Symptomen nach COVID-19 Impfung (beschrieben als Long COVID ähnlich) ist noch inkonsistent Sollten hier nach Impfung Auffälligkeiten bestehen, ist dennoch die Meldung unerwünschter Nebenwirkungen bzw. Komplikationen ein guter Weg, auch in Österreich eine bessere Datenlage dazu zu schaffen. NB: Es besteht Meldepflicht - das gilt auch für den Verdachtsfall.“ Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315, die Sekretion von entzündungsfördernden Zytokinen stimulieren. Laut Angaben Robert J. Dunlop et al. (2000) spielen Zytokine eine wichtige Rolle bei der Förderung des Wachstums und der Ausbreitung von Krebserkrankungen. Bei Krebspatienten sind erhöhte Werte verschiedener Zytokine beschrieben worden. Tier- und Humanstudien deuten darauf hin, dass Zytokine zu einer Vielzahl von Symptomen bei fortgeschrittener Krebserkrankung beitragen können, darunter Schwächung - Kraftlosigkeit, Schmerzen, Schläfrigkeit, kognitives Versagen, agitatorisches Delirium, autonome Dysfunktion, Anorexie, Kachexie, Fieber und Stoffwechselanomalien. Kationische Lipide, wie ALC-0315, können, laut Angaben Xucheng Hou et al. (Dezember 2021) auch die Sekretion von reaktiven Sauerstoffspezies stimulieren, was laut Angaben Michael Schieber et al. (2014) zu oxidativem Stress führt, der laut Angaben Mehdi Sharifi-Rad et al. (2020), eine wesentliche Rolle bei der Entstehung chronischer Krankheiten wie Krebs, Herz-Kreislauf-Erkrankungen, Diabetes und neurodegenerativen Erkrankungen spielt, die ebenfalls mit Schwächung - Kraftlosigkeit usw. einher gehen. Wie aus Fachpublikationen hervorgeht ist die Datenlage zu Symptomen wie Müdigkeit, Abgeschlagenheit, Konzentrationsschwäche und Schlafstörungen oder anderen unspezifischen Symptomen nach COVID-19 Impfung (beschrieben als Long COVID ähnlich) noch inkonsistent. Diese Symptome könnten auf die Stimulation der Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies zurückzuführen sein, die durch kationische Lipide, wie ALC-0315, verursacht wird. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden zum neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Wurde von den Impfstoffherstellern BioNTech - Pfizer Inc. untersucht, ob die Symptome Müdigkeit, Abgeschlagenheit, Konzentrationsschwäche und Schlafstörungen im Zusammenhang mit der Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty und dem darin enthaltenen kationischen Lipid ALC-0315 stehen und wurde dies, auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden untersucht?
14:
Aus der Website apotheken-umschau.de geht hervor: „Die Thrombozyten spielen bei der Entstehung der Gefäßverkalkung (Arteriosklerose) oder von Gefäßverschlüssen wie dem Herzinfarkt eine zentrale Rolle. Wann sind die Thrombozyten vermehrt?“… „Eine erhöhte Thrombozytenzahl kommt unter anderem vor: in Verbindung mit Entzündungsreaktionen, bei Erkrankungen des Knochenmarks (Polyzythämie/ Thrombozythämie).“ Aus der Website mpn-netzwerk.de geht hervor: „Eine anormal hohe Zahl von Thrombozyten im Blut erhöht in der Regel auch deren Neigung zu verklumpen, wodurch sich Blutgerinnsel bilden können. Dadurch steigt das Risiko für Durchblutungsstörungen, die bis zum Gefäßverschluss führen können.“ Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315, die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies stimulieren. Dies verursacht oxidativen Stress und Entzündungen. Dies führt wiederum zur Erhöhung der Thrombozytenzahl. Eine anormal hohe Zahl von Thrombozyten im Blut erhöht in der Regel auch deren Neigung zu verklumpen, wodurch sich Blutgerinnsel bilden können. Dadurch steigt das Risiko für Durchblutungsstörungen, die bis zum Gefäßverschluss führen können. Eine abnorm hohe Zahl an Thrombozyten spielt bei der Entstehung der Gefäßverkalkung (Arteriosklerose) oder von Gefäßverschlüssen wie dem Herzinfarkt eine zentrale Rolle. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die übermäßigen Mengen von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, erzeugt werden, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, zu keinerlei Art von langfristiger Erhöhung der Thrombozytenzahl führt, die zur Bildung von gesundheits- und lebensbedrohenden Durchblutungsstörungen wie z.B. Blutgerinnseln führen kann?
Aus der Studie von Sonia Ndeupen et al. (Dezember 2021) The mRNA-LNP platform’s lipid nanoparticle component used in preclinical vaccine studies is highly inflammatory (Seite1) geht hervor: „A preclinical study showed that nucleoside-modified mRNA complexed with Acuitas Therapeutics’ LNPs containing proprietary ionizable lipid has adjuvant activity (Pardi et al., 2018a). However, the potential inflammatory nature of these LNPs was not assessed (Alameh et al., 2020; Pardi et al., 2018a).“
(Seite 1) „The human clinical trials of the Pfizer/BioNTech and Moderna vaccines have reported side effects such as pain, swelling, fever, and sleepiness (Jackson et al., 2020; Sahin et al., 2020; Walsh et al., 2020). Under the presumption that this vaccine platform is noninflammatory, some of the clinicians and public health communicators interpreted these reported acute side effects as the vaccine being potent and generating an adaptive immune response. These side effects, however, are more in line with acute inflammatory responses induced by the vaccine. Still, no studies have been undertaken to characterize the immediate innate inflammatory reactions induced by this vaccine platform that could potentially cause the local and systemic side effects. Therefore, in this study, we took a systematic approach, focusing our attention on the injection site and analyzing the inflammatory reactions caused by the LNPs used for preclinical vaccine studies (Awasthi et al., 2019; Laczko´ et al., 2020; Lederer et al., 2020; Pardi et al., 2017, 2018a, 2018b). Using complementary techniques, we show that in mice intradermal, intramuscular, or intranasal delivery of LNPs used in preclinical studies triggers inflammation characterized by leukocytic infiltration, activation of
(Seite 2) different inflammatory pathways, and secretion of a diverse pool of inflammatory cytokines and chemokines. Thus, the inflammatory milieu induced by the LNPs could be partially responsible for reported side effects of mRNA-LNP-based SARS-CoV-2 vaccines in humans and are possibly contributory to their reported high potency for eliciting antibody responses.
(Seite 6) The ionizable lipids were developed to overcome the inflammatory nature of the permanently charged cationic lipids (Kulkarni et al., 2018). However, we found that the proprietary ionizable lipid component of these LNPs is inflammatory (Figures 1C and 1D). The inflammatory responses triggered by the LNPs alone or complexed with mRNAs were independent of the delivery route and were dominated by neutrophil infiltration. Despite the induction of phenotypically similar innate inflammatory responses, unlike intradermal and intramuscular inoculations, intranasal delivery of 2.5 mg of mRNA-LNP coding for PR8 HA did not lead to detectable levels of adaptive immune responses (unpublished observation). Thus, slight differences are likely to exist between the route of administration, which warrants further investigation to optimize this platform for intranasal use. Understanding the cellular and molecular differences between intradermal/intramuscular and
(Seite 7) intranasal delivery sites that underline this dissimilarity in adaptive immune responses might also help to decipher why certain people do not react to the intramuscularly delivered mRNA-LNP vaccines.
Humans present various side effects, most often pain, swelling, fever, and chills, after intramuscular vaccination with the Pfizer/BioNTech or Moderna vaccines (Jackson et al., 2020; Sahin et al., 2020; Walsh et al., 2020). These are typical symptoms associated with inflammation triggered by cytokines such as IL-1b and IL-6 (Dinarello, 2018; Tanaka et al., 2014). Along with causing local inflammatory responses, these cytokines also act as major endogenous pyrogens (Conti, 2004) and instruct the hypothalamus to increase the body’s temperature (fever) to help overcome possible infections. In concordance with this, the intradermal inoculation of LNPs in mice led to the secretion of large amounts of major and minor pyrogens, IL-1b/IL-6 and macrophage inflammatory protein-a (CCL3) and macrophage inflammatory protein-b (CCL4), respectively (Figures 2B and 2C). Furthermore, the observed activation of other inflammatory pathways and cell death could further accentuate the experienced side effects. However, further studies will be needed to determine the exact nature of the inflammatory responses triggered by mRNA-LNP vaccines in humans and how much overlap there might be with the inflammatory signatures documented here for mice.
It remains to be determined how these LNPs or their ionizable lipid component activate distinct inflammatory pathways. In theory, LNPs could activate multiple pathways or alternatively engage only one that would initiate an inflammatory cascade. Some cationic/ionizable lipids bind and activate TLRs (Lonez et al., 2012, 2014; Samaridou et al., 2020; Tanaka et al., 2008). Our GSEA analyses are consistent with TLR engagement by these proprietary LNPs, among others (Figure 2F). We also observed upregulation of inflammasome components such Nlrp3 and enrichment of genes involved in necroptosis. Inflammatory cell death, such as necroptosis and pyroptosis, could cause the release of DAMPs and the further enhancement of inflammation. The synthetic ionizable lipid in the Pfizer SARS-CoV-2 vaccine has been speculated to have approximately 20–30 days of halflife in humans (Comirnaty, 2021). Whether the long-term presence of ionizable lipid could lead to low levels of chronic inflammation and immune exhaustion (Wherry and Kurachi, 2015) remain to be determined.“[12]
15:
Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 1) wurde der potenziell entzündliche Charakter von Lipidnanopartikeln, die kationische Lipide, wie ALC-0315, enthalten nicht bewertet. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
Frage 16: Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 1) wurde in den klinischen Studien mit den Impfstoffen von Pfizer/BioNTech und Moderna Nebenwirkungen wie Schmerzen, Schwellungen, Fieber und Schläfrigkeit berichtet. Unter der Annahme, dass die Art der Impfstoffplattform, wie sie von Pfizer/BioNTech verwendet wird, nicht entzündlich ist, interpretierten einige Kliniker und Vertreter des öffentlichen Gesundheitswesens diese gemeldeten akuten Nebenwirkungen so, dass der Impfstoff wirksam ist und eine adaptive Immunantwort hervorruft. Diese Nebenwirkungen stehen laut, Angaben Sonia Ndeupen et al. (Dezember 2021), jedoch eher im Einklang mit akuten Entzündungsreaktionen, die durch den Impfstoff ausgelöst werden. Bisher wurden, laut Angaben Sonia Ndeupen et al. (Dezember 2021), jedoch keine Studien durchgeführt, um die unmittelbaren Entzündungsreaktionen zu beschreiben, die durch diese Impfstoffplattform ausgelöst werden und die möglicherweise die lokalen und systemischen Nebenwirkungen verursachen könnten. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
17:
Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 2) könnte das von den Lipidnanopartikeln, wie ALC-0315, induzierte Entzündungsmilieu teilweise für die gemeldeten Nebenwirkungen von mRNA-LNP-basierten SARS-CoV-2-Impfstoffen beim Menschen verantwortlich sein und möglicherweise zu ihrer gemeldeten hohen Wirksamkeit bei der Auslösung von Antikörperreaktionen beitragen. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
18:
Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 6) wurde festgestellt, dass die proprietäre ionisierbare Lipidkomponente, wie ALC-0315, von Lipidnanopartikeln entzündlich ist. Die Entzündungsreaktionen, die durch die Lipidnanopartikel allein oder im Komplex mit mRNAs ausgelöst wurden, waren unabhängig vom Verabreichungsweg und wurden durch die Infiltration von Neutrophilen dominiert. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al (Dezember 2021)?
19:
Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 7) sind weitere Studien erforderlich, um die genaue Art, der durch mRNA-LNP-Impfstoffe beim Menschen ausgelösten Entzündungsreaktionen zu bestimmen, um festzustellen, inwieweit es Überschneidungen, mit den für Mäuse dokumentierten Entzündungssignaturen geben könnte. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
20:
Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 7) bleibt noch zu klären, wie Lipidnanopartikel oder ihre ionisierbare Lipidkomponente, wie ALC-0315, verschiedene Entzündungswege aktivieren. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
21:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben einige Unsicherheiten bezüglich der langen Halbwertszeit von ALC-0315. Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 7) wird von der EMA „vermutet“, dass das synthetische, ionisierbare Lipid im Pfizer SARS-CoV-2-Impfstoff eine Halbwertszeit von etwa 20-30 Tagen im Menschen hat (Comirnaty, 2021). Ob das langfristige Vorhandensein ionisierbarer Lipide zu einem niedrigen Niveau chronischer Entzündungen und einer Erschöpfung des Immunsystems führen könnte, muss noch ermittelt werden. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
22:
Laut Angaben Xucheng Hou et al. (Dezember 2021) können Anti-PEG-Antikörper im Organismus zu einer schnellen systemischen Clearance von verabreichten PEGylierten Nanopartikeln, wie ALC-0159, durch eine beschleunigte Blut-Clearance führen. Das Phänomen der beschleunigten Blutausscheidung kann die Bioverfügbarkeit und die biologische Verteilung des in PEGylierten Nanopartikeln verkapselten Arzneimittels verändern und somit Nebenwirkungen verursachen. Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht?
23:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden zum neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Kationische Lipide, wie ALC-0315, können, laut Angaben Xucheng Hou et al. (Dezember 2021), die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies stimulieren. Zytokine und reaktive Sauerstoffspezies können, laut Robert J. Dunlop et al. (2000), eine wichtige Rolle bei der Förderung, des Wachstums und der Ausbreitung von Krebserkrankungen spielen. Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht?
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Kationische Lipide, wie ALC-0315, können, laut Angaben Xucheng Hou et al. (Dezember 2021), die Sekretion von reaktiven Sauerstoffspezies stimulieren. Ein zu hoher Anteil an reaktiven Sauerstoffspezies im menschlichen Organismus löst oxidativen Stress aus. Oxidativer Stress spielt eine wesentliche Rolle bei der Entstehung chronischer Krankheiten wie Krebs, Herz-Kreislauf-Erkrankungen, Diabetes und neurodegenerativen Erkrankungen. Oxidativer Stress soll auch dem zentralen Nervensystem schaden und zu Krankheiten wie Schlaganfall, Parkinson oder Alzheimer führen können (Michael Schieber et al. (2014) und Mehdi Sharifi-Rad et al. (2020)). Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht?
25:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Die Sekretion von Zytokinen und reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, kann zur Entstehung von kardiovaskulären Erkrankungen wie Myokarditis führen, die auch Herzstillstände mit Todesfolge verursachen kann. Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht?
26:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Kationische Lipide wie ALC-0315 können die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies stimulieren. Dies verursacht oxidativen Stress und Entzündungen. Dies führt wiederum zur Erhöhung der Thrombozytenzahl. Eine anormal hohe Zahl von Thrombozyten im Blut erhöht auch deren Neigung zu verklumpen, wodurch sich Blutgerinnsel bilden können. Dadurch steigt das Risiko für Durchblutungsstörungen wie die Bildung von Blutgerinnseln, die bis zum Gefäßverschluss führen können. Eine abnorm hohe Zahl an Thrombozyten spielt bei der Entstehung der Gefäßverkalkung (Arteriosklerose) oder von Gefäßverschlüssen, wie dem Herzinfarkt, eine zentrale Rolle. Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht?
27:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Kationische Lipide wie ALC-0315 können die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies stimulieren von diesen Auswirkungen könnten auch Endothelzellen betroffen sein. Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht?
28:
BASG - Bericht über Meldungen vermuteter Nebenwirkungen nach Impfungen zum Schutz vor COVID-19 Berichtszeitraum 27.12.2020 – 22.04.2022[13]
Dem Bundesamt für Sicherheit im Gesundheitswesen (BASG) wurden 282 Todesfälle in zeitlicher Nähe zu einer Impfung gegen COVID-19 gemeldet (216 BioNTech/Pfizer, 26 Moderna, 36 AstraZeneca und 4 Janssen). Bei 7 Patient*innen konnte aufgrund des Obduktionsberichts ein Zusammenhang mit der Impfung ausgeschlossen werden.
Bisher wurden in zeitlicher Nähe zu einer Impfung gegen COVID-19 319 Fälle einer Herzmuskelentzündung gemeldet (258 BioNTech/Pfizer, 33 Moderna, 19 AstraZeneca und 9 Janssen). Insgesamt wurden davon 5 Todesfälle (4 BioNtech/Pfizer, 1 AstraZeneca) gemeldet.
Bei 548 Patient*innen wurden die Nebenwirkungen als lebensbedrohend gemeldet (398 BioNTech/Pfizer, 48 Moderna, 83 AstraZeneca und 19 Janssen), bei insgesamt 173 Personen konnte der Gesundheitszustand wiederhergestellt werden. 375 weitere Fälle sind noch in Abklärung bzw. wurden keine weiteren Informationen übermittelt.
Nur sechs Prozent der unerwünschten Nebenwirkungen von Arzneimitteln werden laut Experten des Verbandes der pharmazeutischen Industrie Österreichs (Pharmig) in Österreich gemeldet.[14]
28:
Das Dahinscheiden von betagten Personen, in zeitlicher Nähe zur Impfung zum Schutz vor COVID-19, könnte ein Alarmsignal sein. Betagte Personen befinden sich oft in einem schlechteren gesundheitlichen Zustand und versterben daher vielleicht schneller an den Folgen von oxidativem Stress, der durch kationische Lipide, wie z.B. ALC-0315, durch die Sekretion von reaktiven Sauerstoffspezies, ausgelöst werden kann. Dies ist wegen der, laut EMA, verbleibenden Unsicherheiten bezüglich der langen Halbwertszeit von ALC-0315 EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) von besonderer Bedeutung. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
28 a.:
Nachdem der Bayer AG laut Deutschem Ärzteblatt[15] 52 Todesfälle, 5 davon in Deutschland, in einem zeitlichen Zusammenhang mit der Einnahme des Cholesterinsynthesehemmers Cerivastatin gemeldet worden waren, erfolgte ein Verkaufsstopp des Cholesterinsenkers Cerivastatin. In zeitlicher Nähe zur Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs wurden in Österreich bis 22.04.2022 in Summe 216 Todesfälle gemeldet. Warum wurde die Verabreichung von Pfizer/BioNTech Comirnaty nicht gestoppt?
29:
Wie einer Datenbank zur Meldung von Verdachtsfällen unerwünschter Wirkungen von Impfstoffen im Ausland - VAERS, an die auch das BASG meldet, entnommen werden kann, wurden zu Nummern von Impfchargen - Pfizer/BioNTech COVID-19 Impfstoff, die auch in Österreich verabreicht wurden, die folgenden Zahlen zu Todesfällen in zeitlicher Nähe zur Impfung zum Schutz vor COVID-19 gemeldet. - Datenstand 13.05.2022
Zur Pfizer/BioNTech Impfchargennummer ET7205 wurden in Summe 72 Todesfälle gemeldet.[16] Zur Pfizer/BioNTech Impfchargennummer EW2239 wurden in Summe 82 Todesfälle gemeldet.[17] Zur Pfizer/BioNTech Impfchargennummer EW2246 wurden in Summe 67 Todesfälle gemeldet.[18] Zur Pfizer/BioNTech Impfchargennummer EW4815 wurden in Summe 55 Todesfälle gemeldet.[19] Zur Pfizer/BioNTech Impfchargennummer FC2473 wurden in Summe 12 Todesfälle gemeldet. Zu dieser Chargennummer stammten alle Meldungen zu Todesfällen aus Österreich.[20]
Welche Dokumente und Stellungnahmen sind zu den oben angeführten Impfchargennummern verfügbar? OMCL`s, Europäisches Direktorat für die Qualität von Arzneimitteln - EDQM, Bundesministerium, BASG/AGES MEA.
30:
Zu welchen Impfchargennummern von Grippeimpfstoffen wurde in der Vergangenheit, eine ähnlich hohe Anzahl an Todesfällen, in zeitlicher Nähe zur Verabreichung eines Vakzins gemeldet, wie es beim Pfizer/BioNTech COVID-19 Impfstoff nun der Fall ist? Wir ersuchen das Bundesministerium nicht auf Studien zum Pfizer/BioNTech COVID-19 Impfstoff aus dem Ausland wie z.B. von Pfizer/BioNTech zu verweisen, sondern österreichspezifische Daten und Fakten zu übermitteln, da Experten z.B. den Verweis auf Länder, die eine andere Lockdownpolitik als Österreich verfolgten, ebenfalls als unzulässig ansehen. Es müssen daher auch österreichspezifische Daten zur Anzahl von Todesfällen in zeitlicher Nähe zur Verabreichung eines anderen Vakzins nach Impfchargennummern wie z.B. von Grippeimpfstoffen, aus der Vergangenheit, vorhanden sein. Wie sollte ansonsten ein österreichspezifischer Vergleich mit Impfchargennummern von anderen Vakzinen wie z.B. Grippeimpfstoffen möglich sein, um nach Impfchargennummern dokumentieren zu können, dass vom Pfizer/BioNTech COVID-19 Impfstoff keine erhöhte Gefahr für Gesundheit- und Leben der österreichischen Bevölkerung ausgeht. Wie hoch ist daher die Anzahl, der in Österreich, in zeitlicher Nähe zur Verabreichung eines Grippeimpfstoffs gemeldeten Todesfälle, im Vergleich zur Anzahl, der in Österreich, in zeitlicher Nähe zur Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs gemeldeten Todesfälle, pro 100.000 verabreichter Dosen?
31:
Wie das US-Department of Justice[21] am 02.09.2009 bekannt gab, wurde das Pharmaunternehmen Pfizer zur Zahlung einer Strafe von 2,3 Milliarden USD wegen betrügerischem Marketing verurteilt. Wie das US-Department of Justice bekannt gab, war das bisher der größte Vergleich mit Bezug auf Betrug in der Geschichte des Gesundheitswesens gewesen. Die österreichische Regierung bestellte und bestellt vornehmlich COVID-19 mRNA-Impfstoffdosen bei Pfizer/BioNTech. Wie lautet die Stellungnahme des Bundesministeriums zum Ankauf von COVID-19 mRNA-Impfdosen von Pfizer/BioNTech mit Bezug auf die Verlautbarung des US-Department of Justice zum Pharmaunternehmen Pfizer?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 23) geht hervor: „All excipients except the functional lipids ALC-0315 and ALC-0159 and the structural lipid DSPC comply with Ph. Eur. The functional lipid excipients ALC-0315 and ALC-0159, are classified as novel excipients. Both structural lipids DSPC and cholesterol are used in several already approved finished products. A justification was provided for why DSPC is not considered to be a novel excipient.“ und „Novel excipients: Two novel excipients are included in the finished product, the cationic lipid ALC-0315 and the PEGylated lipid ALC-0159. Limited information regarding the novel excipients are provided.“ und (Seite 24) Lipid related impurities have been observed in some recently manufactured finished product batches, correlated with ALC-0315 lipid batches. The quality of ALC-0315 excipient is considered acceptable based on the available data on condition that specific impurities in the finished product will be further evaluated (SO2). und (Seite 35) Lipid related impurities were observed in recently produced finished product batches. Based on the low dose (30 µg mRNA) it is considered that the amounts of these impurities are too low to be of toxicological significance. und (Seite 28) ALC-0315 and ALC-0159 are novel excipients, not previously used in an approved finished product within EU. Und (Seite 48) While there was no detectable excretion of either lipid in the urine, the percent of dose excreted unchanged in faeces was ~1% for ALC-0315 and ~50% for ALC-0159. Since almost no unchanged ALC-3015 was detected in urine or faeces, metabolism may play a bigger role in the elimination of ALC-0315 than ALC-0159. und (Seite 50) „No genotoxicity studies have been provided. This is acceptable as the components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ und (Seite 55) „No genotoxicity nor carcinogenicity studies have been provided. The components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ und (Seite 56) „As per guidance, no genotoxicity nor carcinogenicity studies were performed. The components of the vaccine (lipids and mRNA) are not expected to have genotoxic potential. This is acceptable to the CHMP.“ und (Seite 134) „This vaccine contains two new components (cationic lipid ALC-0315 and PEGylated liquid ALC-0159) in the LNP, for which there is limited experience. Some uncertainties remain regarding the ALC-0315 long half-life.“
Aus der EMA Richtline: Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT (Seiten 5 u. 6) geht hervor: „4.6 Novel Excipients (3.2.P.4.6) Full details of manufacture, characterisation and controls with cross references to supporting safety data should be provided for novel excipients, according to the drug substance format.“
a) A detailed description of the excipient, its function and its conditions of use should be provided. If the excipient is complex or consists of a mixture of compounds, the composition should be specified in qualitative and quantitative terms.
b) For novel excipients and for excipients presented as a mixture of compounds the following should be taken into consideration:
• Any bibliographical data on the chemistry and on the toxicology and the field in which the product is already used.[22]
32:
Laut Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 23) entsprechen die medizinischen Hilfsstoffe funktionelles, kationisches Lipid ALC-0315 und funktionelles PEGyliertes Lipid ALC-0159 nicht dem Europäischen Arzneibuch und sind darin nicht eintragen. Auch in keinem anderen Arzneibuch der Welt sind diese neuartigen, funktionellen, medizinischen Hilfsstoffe eingetragen. Die funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 wurden von der EMA daher als neuartige, medizinische Hilfsstoffe eingestuft. Im Zusammenhang mit den neuartigen medizinischen Hilfsstoffen ALC-0315 und ALC-0159 erfolgt von der EMA auch ein ausdrücklicher Hinweis, dass zu den neuartigen medizinischen Hilfsstoffen ALC-0315 und ALC-0159 nur begrenzte Informationen vorgelegt wurden EMA Assessment Report Comirnaty (19.02.2021) (Seite 23). In einigen Fertigproduktchargen wurden, laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 35) lipidbedingte Verunreinigungen festgestellt, die mit ALC-0315-Lipidchargen korrelierten. Die Qualität des neuartigen, medizinischen Hilfsstoffs funktionelles kationisches Lipid ALC-0315 wurde von der EMA auf der Grundlage der verfügbaren, begrenzten, Daten nur unter der Bedingung als akzeptabel angesehen, wenn die spezifischen Verunreinigungen im Fertigprodukt weiter bewertet werden (SO2) EMA Assessment Report Comirnaty (19.02.2021) (Seite 24). Aufgrund der niedrigen Dosis (30 µg mRNA) ging die EMA davon aus, dass die Mengen dieser Verunreinigungen zu gering sind, um von toxikologischer Bedeutung zu sein EMA Assessment Report Comirnaty (19.02.2021) (Seite 35). Zu den neuartigen, medizinischen Hilfsstoffen funktionelles, kationisches Lipid ALC-0315 und PEGyliertes Lipid ALC-0159 wurden laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) jedoch weder Studien zur Genotoxizität oder Karzinogenität durchgeführt, da es sich bei den Bestandteilen der Impfstoffformulierung Pfizer/BioNTech COVID-19 Impfstoff Comirnaty um Lipide (ALC-0315 und ALC-0159) handelt, bei denen, laut EMA, kein genotoxisches Potenzial zu „erwarten“ ist. Aufgrund welcher datenbasierten, wissenschaftlichen Erkenntnisse, diese Erwartungshaltung der EMA besteht, wird von der EMA nicht erläutert. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) existieren für die beiden neuartigen, medizinischen Hilfsstoffe funktionelles, kationisches Lipid ALC-0315 und funktionelles, PEGyliertes Lipid ALC-0159 nur begrenzte Erfahrungen und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Die medizinischen Hilfsstoffe kationisches Lipid ALC-0315 und PEGyliertes Lipid ALC-0159 sind neuartige Hilfsstoffe, die bisher noch nie in einem in der EU zugelassenen Fertigprodukt verwendet wurden EMA Assessment Report Comirnaty (19.02.2021) (Seite 28). Während von beiden Lipiden keine Ausscheidung im Urin der Versuchstiere nachweisbar war, betrug der prozentuale Anteil, der unverändert mit den Faeces ausgeschiedenen Dosis ~1% für ALC-0315 und ~50% für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien der Versuchstiere nachgewiesen wurde, „könnte“ der Stoffwechsel, laut EMA, eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen EMA Assessment Report Comirnaty (19.02.2021) (Seite 48). Laut EMA existieren für die beiden neuartigen, medizinischen Hilfsstoffe funktionelles, kationisches Lipid ALC-0315 und funktionelles, PEGyliertes Lipid ALC-0159 nur begrenzte Erfahrungen und es verbleiben laut EMA einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 EMA Assessment Report Comirnaty (19.02.2021) (Seite 134). Es ist also unbekannt für welchen Zeitraum ALC-0315 nach der Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty im Organismus verbleibt. Die Bewertung, von vor allem ALC-0315, aber auch von ALC-0159 durch die EMA erfolgte aufgrund von Erwartungen hinsichtlich Genotoxizität und Karzinogenität, nicht aber aufgrund von wissenschaftlichen Fakten. Mit Bezug auf die Ausscheidung von ALC-0315 durch den Organismus stellt die EMA Vermutungen an und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Die Vorlage von Informationen zu den neuartigen Hilfsstoffen ALC-0315 und ALC-0159 war begrenzt und ebenso sind die Erfahrungen mit diesen neuartigen Impfstoffkomponenten begrenzt. Stehen die Angaben zu den neuartigen, medizinischen Hilfsstoffen funktionelles, kationisches Lipid ALC-0315 und funktionelles, PEGyliertes Lipid ALC-0159 im Pfizer/BioNTech Comirnaty COVID-19 Impfstoff, im EMA Assessment Report Comirnaty (19.02.2021) auf den Seiten 23, 24, 28, 35, 48, 50, 55, 56 und 134 im Einklang mit den Angaben in der EMA Richtline: Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT auf (Seite 5) : Punkt c) "pharmazeutische Hilfsstoffe, die in keinem Arzneibuch beschrieben sind: Es sollte eine geeignete Spezifikation für den Hilfsstoff erstellt werden, die auf den folgenden Arten von Tests basiert: Physikalische Eigenschaften, Identifizierungstests, Reinheitstests, einschließlich Grenzwerte für Gesamt- und Einzelverunreinigungen, die z. B. unter Bezugnahme auf eine chromatographische relative Retentionszeit angegeben werden sollten. Reinheitstests können physikalisch, chemisch, biologisch und gegebenenfalls immunologisch sein. Erforderlichenfalls Assay- oder Grenzwerttests und entsprechende Validierungsparameter. Andere relevante Prüfungen, z. B. Prüfungen von (quantitativen) Parametern, die nachweislich die Leistung der Darreichungsform beeinflussen?“ Wie lautet die Stellungnahme des Bundesministeriums?
32 a.:
Die Angaben zu den neuartigen, medizinischen Hilfsstoffen funktionelles, kationisches Lipid ALC-0315 und funktionelles PEGyliertes Lipid ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff im EMA Assessment Report Comirnaty (19.02.2021) auf den Seiten 23, 24, 28, 35, 48, 50, 55, 56 und 134 stehen im Widerspruch zur EMA Richtline: Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT, (Seiten 5 u. 6) Absatz „4.6 Neuartige Hilfsstoffe (3.2.P.4.6) „Für neuartige, pharmazeutische Hilfsstoffe sollten entsprechend dem Format des Arzneimittels vollständige Angaben zu Herstellung, Charakterisierung und Kontrollen mit Querverweisen auf unterstützende Sicherheitsdaten gemacht werden. a) Es sollte eine detaillierte Beschreibung des Hilfsstoffs, seiner Funktion und seiner Verwendungsbedingungen vorgelegt werden. Ist der Hilfsstoff komplex oder besteht er aus einem Gemisch von Verbindungen, sollte die Zusammensetzung in qualitativer und quantitativer Hinsicht angegeben werden.“ usw. Wie lautet, die Stellungnahme des Bundesministeriums zu diesem Widerspruch?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 34) geht hervor:
„Two novel excipients are included in the LNP. Complete information is not provided for both the cationic lipid ALC-0315 and the PEGylated lipid ALC-0159. In order to assure comprehensive control throughout the lifecycle of the finished product and to ensure batch to batch consistency, further information needs to be submitted regarding the synthetic process and control strategy in line with specific obligations (SO4, SO5). Lipid-related impurities have been observed in some recently manufactured finished product batches. For the batches with lipid-related impurities the existing quality control parameters including RNA integrity remain unchanged.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 35) geht hervor:
„Lipid related impurities were observed in recently produced finished product batches. Based on the low dose (30 µg mRNA) it is considered that the amounts of these impurities are too low to be of toxicological significance.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 23) geht hervor: „All excipients except the functional lipids ALC-0315 and ALC-0159 and the structural lipid DSPC comply with Ph. Eur. The functional lipid excipients ALC-0315 and ALC-0159, are classified as novel excipients. Both structural lipids DSPC and cholesterol are used in several already approved finished products. A justification was provided for why DSPC is not considered to be a novel excipient.“ und „Novel excipients: Two novel excipients are included in the finished product, the cationic lipid ALC-0315 and the PEGylated lipid ALC-0159. Limited information regarding the novel excipients are provided.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 50) geht hervor: „Genotoxicity No genotoxicity studies have been provided. This is acceptable as the components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ und (Seite 55) „No genotoxicity nor carcinogenicity studies have been provided. The components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ und (Seite 56) „As per guidance, no genotoxicity nor carcinogenicity studies were performed. The components of the vaccine (lipids and mRNA) are not expected to have genotoxic potential. This is acceptable to the CHMP.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) geht hervor: „This vaccine contains two new components (cationic lipid ALC-0315 and PEGylated liquid ALC-0159) in the LNP, for which there is limited experience. Some uncertainties remain regarding the ALC-0315 long half-life.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 23) geht hervor: „Lipid-related impurities have been identified in the finished product and have been characterized. An investigation has been initiated and is ongoing to assess and review potential root causes. The outcome of the investigation shall be provided (SO2)“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 24) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 hervor: „Lipid related impurities have been observed in some recently manufactured finished product batches, correlated with ALC-0315 lipid batches. The quality of ALC-0315 excipient is considered acceptable based on the available data on condition that specific impurities in the finished product will be further evaluated (SO2).“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 (Seite 6) hervor: „SOB Number: Specific Obligation 2 (SO2), Description (scope): In order to ensure consistent product quality, the MAH should provide additional information to enhance the control strategy, including the active substance and finished product specifications. Due date indicated in Annex II: July 2021, Date of submission: 02/08/2021, Current status: Not Fulfilled“
33:
Im EMA Assessment Report Comirnaty (19.02.2021) wurde vermerkt (Seite 23): "Im Endprodukt wurden lipidbedingte Verunreinigungen festgestellt und charakterisiert. Eine Untersuchung wurde eingeleitet und ist im Gange, um mögliche Ursachen zu bewerten und zu überprüfen. Das Ergebnis der Untersuchung ist vorzulegen (SO2)."
Im EMA Assessment Report Comirnaty (19.02.2021) wurde mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 vermerkt (Seite 24): „In einigen kürzlich hergestellten Chargen des Fertigerzeugnisses wurden lipidbedingte Verunreinigungen festgestellt, die mit den Lipidchargen von ALC-0315 korrelierten. Die Qualität des ALC-0315-Hilfsstoffs wird auf der Grundlage der verfügbaren Daten als akzeptabel angesehen, unter der Bedingung, dass spezifische Verunreinigungen im Endprodukt weiter bewertet werden (SO2).“
Laut EMA Assessment Report Comirnaty (19.02.2021) betrafen die lipidbedingten Verunreinigungen im Endprodukt den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315. Die Qualität des neuartigen, funktionellen, medizinischen Hilfsstoffs ALC-0315 wurde von der EMA, auf der Grundlage der verfügbaren Daten, nur dann als akzeptabel angesehen, wenn die Verunreinigungen im Endprodukt weiter bewertet werden. Dies wurde im EMA Assessment Report Comirnaty (19.02.2021) (Seite 24) unter spezifischer Verpflichtung (SO2) vermerkt.
Im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 zur spezifischen Verpflichtung 2 (SO2) vermerkt: (Seite 6) "SOB-Nummer: Spezifische Verpflichtung 2 (SO2), Beschreibung (Umfang): Um eine gleichbleibende Produktqualität zu gewährleisten, sollte der Zulassungsinhaber zusätzliche Informationen zur Verbesserung der Kontrollstrategie bereitstellen, einschließlich der Spezifikationen des Wirkstoffs und des Endprodukts. In Anhang II angegebenes Fälligkeitsdatum: Juli 2021, Datum der Einreichung: 02/08/2021, Aktueller Status: Nicht erfüllt"
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden mit dem neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zum medizinischen Hilfsstoff ALC-0315 liegen nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). Der aktuelle Status der spezifischen Verpflichtung 2 (SO2) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 6) mit „nicht erfüllt“ vermerkt. Somit wird die Qualität des neuartigen, medizinischen Hilfsstoffs funktionelles, kationisches Lipid ALC-0315, laut Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 24), von der EMA als nicht akzeptabel angesehen. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
33 a.:
Der aktuelle Status der spezifischen Verpflichtung 2 (SO2) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 6) mit „nicht erfüllt“ vermerkt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden zum neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zu ALC-0315 liegen nur begrenzte Erfahrungen vor und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
33 b.:
Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 24) geht zum neuartigen medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 hervor: „In order to confirm the purity profile and ensure comprehensive quality control and batch-to-batch consistency throughout the lifecycle of the finished product, the applicant should provide additional information about the synthetic process and control strategy for the excipient ALC-0315. (SO4)“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 hervor: „SOB Number: Specific Obligation 4 (SO4), Description (scope): „In order to confirm the purity profile and ensure comprehensive quality control and batch-to-batch consistency throughout the lifecycle of the finished product, the MAH should provide additional information about the synthetic process and control strategy for the excipient ALC-0315. Due date indicated in Annex II: July 2021, Date of submission: 06/01/2021 - 26/07/2021, Current status: Not Fulfilled“
34:
Im EMA Assessment Report Comirnaty (19.02.2021) wurde mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 vermerkt: (Seite 24): „Zur Bestätigung des Reinheitsprofils und zur Gewährleistung einer umfassenden Qualitätskontrolle und einer gleichbleibenden Qualität der einzelnen Chargen während des gesamten Lebenszyklus des Fertigerzeugnisses sollte der Antragsteller zusätzliche Informationen über den Syntheseprozess und die Kontrollstrategie für den Hilfsstoff ALC-0315 vorlegen (SO4).“
Im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde zur spezifischen Verpflichtung 4 (SO4) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 vermerkt: (Seite 8) „SOB-Nummer: Spezifische Verpflichtung 4 (SO4), Beschreibung (Umfang): Zur Bestätigung des Reinheitsprofils und zur Sicherstellung einer umfassenden Qualitätskontrolle und der Konsistenz von Charge zu Charge während des gesamten Lebenszyklus des Endprodukts sollte der Zulassungsinhaber zusätzliche Informationen über den Syntheseprozess und die Kontrollstrategie für den Hilfsstoff ALC-0315 vorlegen. In Anhang II angegebenes Fälligkeitsdatum: Juli 2021, Datum der Einreichung: 06/01/2021 - 26/07/2021, Aktueller Status: Nicht erfüllt“
Laut EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) wurde der aktuelle Status der spezifische Verpflichtung 4 (SO4), mit Bezug auf den medizinischen Hilfsstoff ALC-0315, mit „nicht erfüllt“ vermerkt. Weder zur Bestätigung des Reinheitsprofils noch zur Sicherstellung einer umfassenden Qualitätskontrolle und der Konsistenz von Charge zu Charge während des gesamten Lebenszyklus des Endprodukts hatte der Zulassungsinhaber zusätzliche Informationen über den Syntheseprozess und die Kontrollstrategie für den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 vorgelegt. Obwohl von der EMA bereits im EMA Assessment Report Comirnaty (19.02.2021) (Seite 24) unter SO4 festgelegt, wurde der aktuelle Status der spezifischen Verpflichtung 4 (SO4) im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 mit „nicht erfüllt“ vermerkt.
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden mit dem neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zum medizinischen Hilfsstoff ALC-0315 liegen nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). Der aktuelle Status der spezifischen Verpflichtung (SO4) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) mit „nicht erfüllt“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
34 a.:
Der aktuelle Status der spezifischen Verpflichtung (SO4) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) mit „nicht erfüllt“ vermerkt. Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 38) zur spezifischen Verpflichtung SO4 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 geht hervor: „e) Specified impurities should be further evaluated and appropriate specification limits for individual impurities should be included when more data are available. Acceptance criteria for specified and un-specified impurities should be added to the specification for ALC-0315 and should also be evaluated during stability studies. Due date: July 2021, Interim report: April 2021“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 hervor:
„SOB Number: Specific Obligation SO4 (e), Description (scope): Specified impurities should be further evaluated and appropriate specification limits for individual impurities should be included when more data are available. Acceptance criteria for specified and unspecified impurities should be added to the specification for ALC-0315 and should also be evaluated during stability studies. Due date indicated in Annex II: July 2021, Date of submission: 26/07/2021, Current status: Ongoing“
Im EMA Assessment Report Comirnaty (19.02.2021) wurde zur spezifischen Verpflichtung SO4 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 vermerkt: (Seite 38): „e) Die spezifizierten Verunreinigungen sollten weiter bewertet werden, und es sollten geeignete Spezifikationsgrenzwerte für einzelne Verunreinigungen aufgenommen werden, sobald mehr Daten vorliegen. Akzeptanzkriterien für spezifizierte und nicht spezifizierte Verunreinigungen sollten in die Spezifikation für ALC-0315 aufgenommen und auch während der Stabilitätsstudien bewertet werden. Fälligkeitsdatum: Juli 2021, Zwischenbericht: April 2021“
Im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde zur spezifischen Verpflichtung SO4 (e), mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315, vermerkt: (Seite 8) "SOB-Nummer: Spezifische Verpflichtung SO4 (e), Beschreibung (Umfang): Die spezifizierten Verunreinigungen sollten weiter bewertet werden, und es sollten geeignete Spezifikationsgrenzwerte für einzelne Verunreinigungen aufgenommen werden, sobald mehr Daten verfügbar sind. Akzeptanzkriterien für spezifizierte und nicht spezifizierte Verunreinigungen sollten in die Spezifikation für ALC-0315 aufgenommen und auch während der Stabilitätsstudien bewertet werden. In Anhang II angegebenes Fälligkeitsdatum: Juli 2021, Datum der Einreichung: 26/07/2021, Aktueller Status: Fortlaufend"
35:
Laut EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) wurde der aktuelle Status der spezifische Verpflichtung SO4 (e), mit Bezug auf den medizinischen Hilfsstoff ALC-0315, mit „fortlaufend“ vermerkt. Die spezifizierten Verunreinigungen sollten weiter bewertet werden, und es sollten geeignete Spezifikationsgrenzwerte für einzelne Verunreinigungen aufgenommen werden, sobald mehr Daten verfügbar sind. Akzeptanzkriterien für spezifizierte und nicht spezifizierte Verunreinigungen sollten in die Spezifikation für ALC-0315 aufgenommen und auch während der Stabilitätsstudien bewertet werden. Obwohl von der EMA bereits im EMA Assessment Report Comirnaty (19.02.2021) (Seite 38) unter SO4 e) festgelegt, wurde der aktuelle Status der spezifischen Verpflichtung SO4 (e), im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 als „fortlaufend“ vermerkt. Es existierten daher keine vollständigen Spezifikationsgrenzwerte für einzelne Verunreinigungen mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden mit dem neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zum medizinischen Hilfsstoff ALC-0315 liegen nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). Der aktuelle Status der spezifischen Verpflichtung SO4 (e) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
35 a.:
Der aktuelle Status der spezifischen Verpflichtung SO4 (e) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) mit „fortlaufend“ vermerkt. Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
35 b.:
Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 38) geht zur spezifischen Verpflichtung SO4 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 hervor: „h) Detailed method validation reports for assay, impurities, and residual solvents for ALC-0315 should be provided. Due date: July 2021“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 hervor: „SOB Number: SO4 (h), Description (scope): Detailed method validation reports for assay, impurities, and residual solvents for ALC-0315 should be provided. Due date indicated in Annex II: July 2021, Date of submission: 26/07/2021, Current status: Ongoing“
36:
Im EMA Assessment Report Comirnaty (19.02.2021) wurde zur spezifischen Verpflichtung SO4 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 vermerkt: (Seite 38) „h) Detaillierte Methodenvalidierungsberichte für Assay, Verunreinigungen und Restlösungsmittel für ALC-0315 sollten vorgelegt werden. Fälligkeitsdatum: Juli 2021“
Im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde zur spezifischen Verpflichtung mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 vermerkt (Seite 9): „SOB-Nummer: SO4 (h), Beschreibung (Umfang): Detaillierte Methodenvalidierungsberichte für Assay, Verunreinigungen und Restlösungsmittel für ALC-0315 sollten vorgelegt werden. In Anhang II angegebenes Fälligkeitsdatum: Juli 2021, Datum der Einreichung: 26/07/2021, Aktueller Status: Fortlaufend“
Laut EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) wurde der aktuelle Status der spezifische Verpflichtung SO4 (h), mit Bezug auf den medizinischen Hilfsstoff ALC-0315, mit „fortlaufend“ vermerkt. Detaillierte Methodenvalidierungsberichte für Assay, Verunreinigungen und Restlösungsmittel für ALC-0315 sollten vorgelegt werden. Mit der Validierung einer analytischen Methode soll nachgewiesen werden, dass mit der Durchführung dieser Methode zu jedem Zeitpunkt und unabhängig von der ausführenden Person verlässliche und reproduzierbare Ergebnisse erzielt werden. Es wird der Beweis erbracht, dass die Methode für ihren Einsatzzweck geeignet ist. Mit Bezug auf die Untersuchung zum Nachweis bestimmter Substanzen, Verunreinigungen und Restlösungsmittel für den medizinischen Hilfsstoff ALC-0315 sollten detaillierte Methodenvalidierungsberichte vom Zulassungsinhaber vorgelegt werden. Obwohl von der EMA bereits im EMA Assessment Report Comirnaty (19.02.2021) (Seite 38) unter SO4 h) festgelegt, wurde der aktuelle Status der spezifischen Verpflichtung SO4 (h), im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 als „fortlaufend“ vermerkt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden mit dem neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zum medizinischen Hilfsstoff ALC-0315 liegen nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). Der aktuelle Status der spezifischen Verpflichtung SO4 (h) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
36 a.:
Der aktuelle Status der spezifischen Verpflichtung SO4 (h) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „fortlaufend“ vermerkt. Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
36 b.:
Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus der Studie von Linde Schoenmaker et al. (April 2021) mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability geht hervor: „A drawback of the current mRNA-lipid nanoparticle (LNP) COVID-19 vaccines is that they have to be stored at (ultra)low temperatures. Understanding the root cause of the instability of these vaccines may help to rationally improve mRNA-LNP product stability and thereby ease the temperature conditions for storage. In this review we discuss proposed structures of mRNA-LNPs, factors that impact mRNA-LNP stability and strategies to optimize mRNA-LNP product stability. Analysis of mRNA-LNP structures reveals that mRNA, the ionizable cationic lipid and water are present in the LNP core. The neutral helper lipids are mainly positioned in the outer, encapsulating, wall. mRNA hydrolysis is the determining factor for mRNA-LNP instability. It is currently unclear how water in the LNP core interacts with the mRNA and to what extent the degradation prone sites of mRNA are protected through a coat of ionizable cationic lipids. To improve the stability of mRNA-LNP vaccines, optimization of the mRNA nucleotide composition should be prioritized. Secondly, a better understanding of the milieu the mRNA is exposed to in the core of LNPs may help to rationalize adjustments to the LNP structure to preserve mRNA integrity. Moreover, drying techniques, such as lyophilization, are promising options still to be explored.“[23]
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 38) zur spezifischen Verpflichtung SO4 geht mit Bezug auf den neuartigen, medizinischen Hilfsstoffs funktionelles, kationisches Lipid ALC-0315 hervor: „i) Results of stability studies in accordance with ICH guidelines should be provided. Due date: July 2021, Interim report: April 2021“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoffs funktionelles, kationisches Lipid ALC-0315 hervor: „SOB Number: SO4 (i), Description (scope): Results of stability studies in accordance with ICH guidelines should be provided. Due date indicated in Annex II: July 2021, Date of submission: 26/07/2021, Current status: Ongoing“
37:
Im EMA Assessment Report Comirnaty (19.02.2021) wurde zur spezifischen Verpflichtung SO4 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 vermerkt: (Seite 38) „i) Die Ergebnisse von Stabilitätsstudien gemäß den ICH-Leitlinien sollten vorgelegt werden. Fälligkeitsdatum: Juli 2021, Zwischenbericht: April 2021“
Im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 vermerkt: (Seite 9): „SOB-Nummer: SO4 (i), Beschreibung (Umfang): Ergebnisse von Stabilitätsstudien in Übereinstimmung mit den ICH-Leitlinien sollten bereitgestellt werden. In Anhang II angegebenes Fälligkeitsdatum: Juli 2021, Datum der Einreichung: 26/07/2021, Aktueller Status: Fortlaufend“
Laut EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde der aktuelle Status der spezifische Verpflichtung SO4 (i), mit Bezug auf den medizinischen Hilfsstoff ALC-0315, mit fortlaufend vermerkt. Die Ergebnisse von Stabilitätsstudien gemäß den ICH-Leitlinien sollten vorgelegt werden. Obwohl von der EMA bereits im EMA Assessment Report Comirnaty (19.02.2021) (Seite 38) unter SO4 i) festgelegt, wurde der aktuelle Status der spezifischen Verpflichtung SO4 (i), im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „fortlaufend“ vermerkt. Die Ergebnisse von Stabilitätsstudien gemäß den ICH-Leitlinien mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurden nicht vollständig vorgelegt. Stabilitätsstudien sind ein zentraler Baustein bei der Entwicklung und Zulassung neuer pharmazeutischer Wirkstoffe und Arzneimittel. Die Prüfungen gewährleisten, dass das Produkt oder der Wirkstoff die Spezifikationen bei vorgegebenen Lagerbedingungen über die gesamte Haltbarkeitszeit erfüllt. Die EMA verfügt also bisher über keine vollständigen Informationen zur Stabilität des neuartigen, medizinischen Hilfsstoffs funktionelles, kationisches ALC-0315 während der Lagerung. ALC-0315 ist zusammen mit Wasser und der mRNA im Kern der Lipidnanopartikel gelagert und es ist daher anscheinend nicht genau bekannt, wie ALC-0315 mit der mRNA und Wasser während der Lagerung intragieren könnte und wie sich dies auf die Wirksamkeit und Sicherheit des Pfizer/BioNTech COVID-19 Impfstoffs auswirken könnte. Linde Schoenmaker et al. (April 2021) haben die Instabilität von mRNA-Impfstoffen untersucht. Im Kern von Lipidnanopartikeln sind mRNA, kationische Lipide (im Fall von Pfizer/BioNTech - Comirnaty - ALC-0315) und Wasser vorhanden. Die mRNA-Hydrolyse (Spaltung einer chemischen Verbindung durch Reaktion mit Wasser) ist der entscheidende Faktor für die mRNA-LNP-Instabilität. Derzeit ist unklar, wie Wasser im LNP-Kern mit der mRNA interagiert und inwieweit, die für den Abbau anfälligen Stellen der mRNA durch eine Hülle aus kationischen Lipiden geschützt sind.
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden mit dem neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zum medizinischen Hilfsstoff ALC-0315 liegen nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). Der aktuelle Status der spezifischen Verpflichtung SO4 (i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?[24]
37 a.:
Der aktuelle Status der spezifischen Verpflichtung SO4 (i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „fortlaufend“ vermerkt. Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Frage 37 b.: Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 24) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 hervor:
„In order to confirm the purity profile and ensure comprehensive quality control and batch-to-batch consistency throughout the lifecycle of the finished product, the applicant is requested to provide additional information about the synthetic process and control strategy for the excipient ALC-0159. (SO5). und (Seite 25) The proposed specification is considered acceptable based on available data. However, in order to improve impurity control strategy and to ensure batch to batch consistency of the finished product, there are additional information regarding specifications that should be provided (SO5).“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 hervor: „SOB Number: Specific Obligation 5 (SO5), Description (scope): In order to confirm the purity profile and ensure comprehensive quality control and batch-to-batch consistency throughout the lifecycle of the finished product, the MAH should provide additional information about the synthetic process and control strategy for the excipient ALC-0159. Due date indicated in Annex II: July 2021, Date of submission: 06/01/2021 - 26/07/2021, Current status: Not Fulfilled“
Frage 38: Im EMA Assessment Report Comirnaty (19.02.2021) wurde zum neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 vermerkt: (Seite 24) „Zur Bestätigung des Reinheitsprofils und zur Gewährleistung einer umfassenden Qualitätskontrolle und einer gleichbleibenden Qualität der einzelnen Chargen während des gesamten Lebenszyklus des Fertigerzeugnisses wird der Antragsteller gebeten, zusätzliche Informationen über den Syntheseprozess und die Kontrollstrategie für den Hilfsstoff ALC-0159 vorzulegen. (SO5). und (Seite 25) Die vorgeschlagene Spezifikation wird auf der Grundlage der verfügbaren Daten als akzeptabel angesehen. Um jedoch die Strategie zur Kontrolle von Verunreinigungen zu verbessern und die Konsistenz des Fertigerzeugnisses von Charge zu Charge zu gewährleisten, sollten zusätzliche Informationen zu den Spezifikationen vorgelegt werden (SO5).“
Im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde zum neuartigen, medizinischen Hilfsstoff funktionelles PEGyliertes Lipid ALC-0159 vermerkt: (Seite 9) „SOB-Nummer: Spezifische Verpflichtung 5 (SO5), Beschreibung (Umfang): Zur Bestätigung des Reinheitsprofils und zur Sicherstellung einer umfassenden Qualitätskontrolle und der Konsistenz von Charge zu Charge während des gesamten Lebenszyklus des Fertigarzneimittels sollte der Zulassungsinhaber zusätzliche Informationen über den Syntheseprozess und die Kontrollstrategie für den Hilfsstoff ALC-0159 vorlegen. In Anhang II angegebenes Fälligkeitsdatum: Juli 2021, Datum der Einreichung: 06/01/2021 - 26/07/2021, Aktueller Status: Nicht erfüllt“
Laut EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) wurde der aktuelle Status der spezifische Verpflichtung SO5, mit Bezug auf den medizinischen Hilfsstoff ALC-0159, mit „nicht erfüllt“ vermerkt. Weder zur Bestätigung des Reinheitsprofils und noch zur Sicherstellung einer umfassenden Qualitätskontrolle und der Konsistenz von Charge zu Charge während des gesamten Lebenszyklus des Fertigarzneimittels hatte der Zulassungsinhaber Informationen über den Syntheseprozess und die Kontrollstrategie für den Hilfsstoff ALC-0159 vorgelegt. Obwohl von der EMA bereits im EMA Assessment Report Comirnaty (19.02.2021) (Seite 24) unter SO5 festgelegt, wurde der aktuelle Status der spezifischen Verpflichtung 5 (SO5) im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit Bezug den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 als „nicht erfüllt“ vermerkt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden mit dem neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zum medizinischen Hilfsstoff ALC-0159 liegen nur begrenzte Erfahrungen vor (Seite 134). Der aktuelle Status der spezifischen Verpflichtung SO5 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles PEGyliertes Lipid ALC-0159, wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „nicht erfüllt“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
38 a.:
Der aktuelle Status der spezifischen Verpflichtung SO5 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „nicht erfüllt“ vermerkt. Warum kann die Verwendung von ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
38 b.:
Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 39) zur spezifischen Verpflichtung SO5 geht mit Bezug auf den neuartigen, medizinischen Hilfsstoffs funktionelles, PEGyliertes Lipid ALC-0159 hervor: „e) Specified impurities should be further evaluated and appropriate specification limits for individual impurities should be included when more data are available. Acceptance criteria for specified and un-specified impurities should be added to the specification for ALC-0159 and should also be evaluated during stability studies. Due date: July 2021, Interim report: April 2021“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoffs funktionelles, PEGyliertes Lipid ALC-0159 hervor: „SOB Number: SO5 (e), Description (scope): Specified impurities should be further evaluated and appropriate specification limits for individual impurities should be included when more data are available. Acceptance criteria for specified and unspecified impurities should be added to the specification for ALC-0159 and should also be evaluated during stability studies. Due date indicated in Annex II: July 2021, Date of submission: 26/07/2021, Current status: Ongoing“
39:
Im EMA Assessment Report Comirnaty (19.02.2021) wurde zur spezifischen Verpflichtung SO5 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 vermerkt (Seite 39): „e) Die spezifizierten Verunreinigungen sollten weiter bewertet werden, und es sollten geeignete Spezifikationsgrenzwerte für die einzelnen Verunreinigungen festgelegt werden, sobald mehr Daten verfügbar sind. Akzeptanzkriterien für spezifizierte und nicht spezifizierte Verunreinigungen sollten in die Spezifikation für ALC-0159 aufgenommen und auch während der Stabilitätsstudien bewertet werden. Fälligkeitsdatum: Juli 2021, Zwischenbericht: April 2021“
Im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 vermerkt: (Seite 10) "SOB-Nummer: SO5 (e), Beschreibung (Umfang): Die spezifizierten Verunreinigungen sollten weiter evaluiert werden und geeignete Spezifikationsgrenzen für einzelne Verunreinigungen sollten aufgenommen werden, sobald mehr Daten verfügbar sind. Akzeptanzkriterien für spezifizierte und nicht spezifizierte Verunreinigungen sollten in die Spezifikation für ALC-0159 aufgenommen und auch während der Stabilitätsstudien bewertet werden. In Anhang II angegebenes Fälligkeitsdatum: Juli 2021, Datum der Einreichung: 26/07/2021, Aktueller Status: Fortlaufend"
Laut EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) wurde der aktuelle Status der spezifische Verpflichtung SO5 (e), mit Bezug auf den medizinischen Hilfsstoff ALC-0159, mit „fortlaufend vermerkt“. Die spezifizierten Verunreinigungen sollten weiter bewertet werden, und es sollten geeignete Spezifikationsgrenzwerte für einzelne Verunreinigungen aufgenommen werden, sobald mehr Daten verfügbar sind. Akzeptanzkriterien für spezifizierte und nicht spezifizierte Verunreinigungen sollten in die Spezifikation für ALC-0159 aufgenommen und auch während der Stabilitätsstudien bewertet werden. Obwohl von der EMA bereits im EMA Assessment Report Comirnaty (19.02.2021) (Seite 39) unter SO5 e) festgelegt, wurde der aktuelle Status der spezifischen Verpflichtung SO5 (e), im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Es existierten daher keine vollständigen Spezifikationsgrenzwerte für einzelne Verunreinigungen im neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159. Laut EMA Assessment Report Comirnaty (19.02.2021) (50, 55, 56) wurden zum neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zum medizinischen Hilfsstoff ALC-0159 liegen nur begrenzte Erfahrungen vor (Seite 134). Der aktuelle Status der spezifischen Verpflichtung SO5 (e) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles PEGyliertes Lipid ALC-0159, wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
39 a.:
Der aktuelle Status der spezifischen Verpflichtung SO5 (e) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Warum kann die Verwendung von ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
39 b.:
Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 39) zur spezifischen Verpflichtung SO5 geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff ALC-0159 funktionelles, PEGyliertes Lipid ALC-0159 hervor: „h) Detailed method validation reports for assay, impurities and residual solvents for ALC-0159 should be provided. Due date: July 2021, Interim report: April 2021“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff ALC-0159 funktionelles, PEGyliertes Lipid ALC-0159 hervor: „SOB Number: SO5 (h), Description (scope): Detailed method validation reports for assay, impurities and residual solvents for ALC-0159 should be provided. Due date indicated in Annex II: July 2021, Date of submission: 26/07/2021, Current status: Ongoing“
40:
Im EMA Assessment Report Comirnaty (19.02.2021) wurde zur spezifischen Verpflichtung SO5 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 vermerkt (Seite 39): „h) Detaillierte Methodenvalidierungsberichte für Assay, Verunreinigungen und Restlösungsmittel für ALC-0159 sollten vorgelegt werden. Fälligkeitsdatum: Juli 2021, Zwischenbericht: April 2021“
Im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde zur spezifischen Verpflichtung SO5 (h) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 vermerkt: (Seite 10) „SOB-Nummer: SO5 (h), Beschreibung (Umfang): Detaillierte Methodenvalidierungsberichte für Assay, Verunreinigungen und Restlösungsmittel für ALC-0159 sollten vorgelegt werden. In Anhang II angegebenes Fälligkeitsdatum: Juli 2021, Datum der Einreichung: 26/07/2021, Aktueller Status: Fortlaufend“
Laut EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) wurde der aktuelle Status der spezifische Verpflichtung SO5 (h), mit Bezug auf den medizinischen Hilfsstoff ALC-0159, mit „fortlaufend“ vermerkt. Detaillierte Methodenvalidierungsberichte für Assay, Verunreinigungen und Restlösungsmittel für ALC-0159 sollten vorgelegt werden. Mit der Validierung einer analytischen Methode soll nachgewiesen werden, dass mit der Durchführung dieser Methode zu jedem Zeitpunkt und unabhängig von der ausführenden Person verlässliche und reproduzierbare Ergebnisse erzielt werden. Es wird der Beweis erbracht, dass die Methode für ihren Einsatzzweck geeignet ist. Mit Bezug auf die Untersuchung zum Nachweis bestimmter Substanzen, Verunreinigungen und Restlösungsmittel für den medizinischen Hilfsstoff ALC-0159 sollten detaillierte Methodenvalidierungsberichte vom Zulassungsinhaber vorgelegt werden. Obwohl von der EMA bereits im EMA Assessment Report Comirnaty (19.02.2021) (Seite 38) unter SO5 h) festgelegt, wurde der aktuelle Status der spezifischen Verpflichtung SO5 (h), im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 als „fortlaufend“ vermerkt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden zum neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zum medizinischen Hilfsstoff ALC-0159 liegen nur begrenzte Erfahrungen vor (Seite 134). Der aktuelle Status der spezifischen Verpflichtung SO5 (h) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159, wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
40 a.:
Der aktuelle Status der spezifischen Verpflichtung SO5 (h) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Warum kann die Verwendung von ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
40 b.:
Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 39) zur spezifischen Verpflichtung SO5 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 geht hervor: „i) Results of stability studies in accordance with ICH guidelines should be provided. Due date: July 2021, Interim report: April 2021“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 hervor: „SOB Number: SO5 (i), Description (scope): Results of stability studies in accordance with ICH guidelines should be provided. Due date indicated in Annex II: July 2021, Date of submission: 26/07/2021, Current status: Ongoing“
41:
Im EMA Assessment Report Comirnaty (19.02.2021) wurde mit Bezug auf den mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 zur spezifischen Verpflichtung SO5 vermerkt (Seite 39): „i) Die Ergebnisse von Stabilitätsstudien gemäß den ICH-Leitlinien sollten vorgelegt werden. Fälligkeitsdatum: Juli 2021, Zwischenbericht: April 2021“
Im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) wurde mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 zur spezifischen Verpflichtung SO5 (i) vermerkt: (Seite 10) „SOB-Nummer: SO5 (i), Beschreibung (Umfang): Ergebnisse von Stabilitätsstudien in Übereinstimmung mit den ICH-Leitlinien sollten vorgelegt werden. In Anhang II angegebenes Fälligkeitsdatum: Juli 2021, Datum der Einreichung: 26/07/2021, Aktueller Status: Fortlaufend“
Die Ergebnisse von Stabilitätsstudien gemäß den ICH-Leitlinien sollten vorgelegt werden. Obwohl von der EMA bereits im EMA Assessment Report Comirnaty (19.02.2021) (Seite 39) unter SO5 i) festgelegt, wurde der aktuelle Status der spezifischen Verpflichtung SO5 (i), im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Die Ergebnisse von Stabilitätsstudien gemäß den ICH-Leitlinien mit Bezug auf den neuartigen, medizinischen Hilfsstoff ALC-0159 wurden nicht vollständig vorgelegt. Stabilitätsstudien sind ein zentraler Baustein bei der Entwicklung und Zulassung neuer pharmazeutischer Wirkstoffe und Arzneimittel. Die Prüfungen gewährleisten, dass das Produkt oder der Wirkstoff die Spezifikationen bei vorgegebenen Lagerbedingungen über die gesamte Haltbarkeitszeit erfüllt. Der EMA verfügt also bisher über keine vollständigen Informationen zur Stabilität des neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 während der Lagerung. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden zum neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159, keine Studien zur Genotoxizität oder Karzinogenität durchgeführt. Zum medizinischen Hilfsstoff ALC-0159 liegen nur begrenzte Erfahrungen vor (Seite 134). Der aktuelle Status der spezifischen Verpflichtung SO5 (i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles PEGyliertes Lipid ALC-0159, wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
41 a.:
Der aktuelle Status der spezifischen Verpflichtung SO5 (i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Zu ALC-0159 liegen nur begrenzte Erfahrungen vor. Warum kann die Verwendung von ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
41 b.:
Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Aus dem EMA Dokument: Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT (Seite 5) geht hervor: „c) „Excipients not described in any pharmacopoeia: An appropriate specification for the excipient should be established, based on the following types of tests: Physical characteristics, Identification tests, Purity tests, including limits for total and individual impurities, which should be named, e.g. by reference to a chromatographic relative retention time. Purity tests may be physical, chemical, biological and, if appropriate, immunological. Assay or limit tests if necessary and corresponding validation parameters. Other relevant tests e.g. tests on parameters (quantitative), which have been determined to influence the performance of the dosage form.“
Aus dem EMA Dokument: Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT (Seiten 5 u. 6) geht hervor: „4.6 Novel Excipients (3.2.P.4.6) Full details of manufacture, characterisation and controls with cross references to supporting safety data should be provided for novel excipients, according to the drug substance format.“
a) A detailed description of the excipient, its function and its conditions of use should be provided. If the excipient is complex or consists of a mixture of compounds, the composition should be specified in qualitative and quantitative terms.
b) For novel excipients and for excipients presented as a mixture of compounds the following should be taken into consideration:
• Any bibliographical data on the chemistry and on the toxicology and the field in which the product is already used.
• For medicinal products for cutaneous use, data on the ingredient used in cosmetic products (see Directive 76/768/EEC, as amended).
• Data concerning the toxicology of the novel excipient according to the dosage form and the route of administration of the medicinal product (if applicable) in Module 4, the safety section of the dossier.
c) Documentation on chemistry of excipients is required for all novel excipients, taking as ist basis the CPMP Guideline on the Chemistry of New Active Substances (CPMP/QWP/130/96) and should include:
• The origin of the excipient, including the name and address of manufacturer.
• A general outline of the manufacturing and purification procedures.
• Structure.
• Physical, chemical properties, identification and purity tests.
• Validated methods of analysis with a presentation of batch results.
• Miscellaneous information (microbiological tests, etc).
• Contamination, presence of foreign substances, residual solvents, etc.
• In the case of an excipient obtained from a mixture of several components, the quality of each component and the physico-chemical tests for the mixture should be described.
• Stability data should be provided as required for the active substances in the Note for Guidance on Stability Testing of New Drug Substances and Products (CPMP/ICH/2736/99).
The routine test procedures and limits should be established on the basis of the documentation given in the dossier.[25]
42:
Wie stehen die Angaben zu den spezifischen Verpflichtungen SO2, SO4, SO4(e), SO4(h), SO4(i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 und die Angaben zu den spezifischen Verpflichtungen SO5, SO5(e), SO5(h), SO5(i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 im EMA Assessment Report Comirnaty (19.02.2021) und im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) im Einklang mit der EMA Leitlinie Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT (Seite 5) c) "pharmazeutische Hilfsstoffe, die in keinem Arzneibuch beschrieben sind: Es sollte eine geeignete Spezifikation für den Hilfsstoff erstellt werden, die auf den folgenden Arten von Tests basiert: Physikalische Eigenschaften, Identifizierungstests, Reinheitstests, einschließlich Grenzwerte für Gesamt- und Einzelverunreinigungen, die z. B. unter Bezugnahme auf eine chromatographische relative Retentionszeit angegeben werden sollten. Reinheitstests können physikalisch, chemisch, biologisch und gegebenenfalls immunologisch sein. Erforderlichenfalls Assay- oder Grenzwerttests und entsprechende Validierungsparameter. Andere relevante Prüfungen, z. B. Prüfungen von (quantitativen) Parametern, die nachweislich die Leistung der Darreichungsform beeinflussen.?“
42 a.:
Die Angaben zu den spezifischen Verpflichtungen SO2, SO4, SO4(e), SO4(h), SO4(i) mit Bezug auf den neuartigen, medizinischen Hilfsstofffunktionelles, kationisches Lipid ALC-0315 und die Angaben zu den spezifischen Verpflichtungen SO5, SO5(e), SO5(h), SO5(i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 im EMA Assessment Report Comirnaty (19.02.2021) und im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) stellen einen Widerspruch zur EMA Leitlinie Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT (Seiten 5 u. 6) Absatz „4.6 Neuartige Hilfsstoffe (3.2.P.4.6) „Für neuartige, pharmazeutische Hilfsstoffe sollten entsprechend dem Format des Arzneimittels vollständige Angaben zu Herstellung, Charakterisierung und Kontrollen mit Querverweisen auf unterstützende Sicherheitsdaten gemacht werden. a) Es sollte eine detaillierte Beschreibung des Hilfsstoffs, seiner Funktion und seiner Verwendungsbedingungen vorgelegt werden. Ist der Hilfsstoff komplex oder besteht er aus einem Gemisch von Verbindungen, sollte die Zusammensetzung in qualitativer und quantitativer Hinsicht angegeben werden.“ usw. dar. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Widerspruch?
In der Antwort des Bundesministeriums 9101/AB vom 14.03.2022 zu 9250/J (XXVII. GP) OK wurde auf die international gültige Richtlinie zur präklinischen Impfstoffentwicklung der WHO (WHO Technical Report Series, No. 927, 2005) und den Absatz 4.2.3 verwiesen - Antwort Frage 20: „Die international gültige Richtlinie zur präklinischen Impfstoffentwicklung der WHO (WHO Technical Report Series, No. 927, 2005) besagt, dass Genotoxiziäts- und Kanzerogenitätsstudien im Normalfall nicht für die Impfstoffentwicklung notwendig sind (Absatz 4.2.3). Zusätzlich durchgeführte toxikologische state-of-the-art Modellierungsprogramme zeigten, dass die Hilfsstoffe in der Pfizer/BioNTech Vakzine gänzlich unbedenklich in Hinsicht auf Genotoxikologie und Kanzerogenese sind. Weiters wird durch die sehr limitierte Verabreichung von Comirnaty und sehr geringe Konzentration von den Hilfsstoffen in Comirnaty der „less-than lifetime toxicological threshold of concern“ (wie in der Guideline ICH M7 definiert) dieser Substanzen bei weitem nicht überschritten. Da dieser international definierte Grenzwert nicht überschritten wird, kann abschließend zusammengefasst werden, dass die Verabreichung von Comirnaty toxikologisch unbedenklich ist.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 28) geht hervor: „ALC-0315 and ALC-0159 are novel excipients, not previously used in an approved finished product within EU.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 50) geht hervor: „Genotoxicity: No genotoxicity studies have been provided. This is acceptable as the components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 55) „No genotoxicity nor carcinogenicity studies have been provided. The components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 56) „As per guidance, no genotoxicity nor carcinogenicity studies were performed. The components of the vaccine (lipids and mRNA) are not expected to have genotoxic potential. This is acceptable to the CHMP.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 41): „No secondary pharmacodynamic, safety pharmacology or pharmacodynamic drug interaction studies have been conducted with BNT162b2 due to the nature of the RNA-based vaccine product, which is according to applicable guidelines (WHO guideline on nonclinical evaluation of vaccines, WHO Technical Report Series, No. 927, 2005).“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 45): „Safety pharmacology studies: No safety pharmacology studies were conducted with BNT162b2. The Applicant refers to that they are not considered necessary according to the WHO guideline (WHO, 2005). In addition, no findings on vital organ functions have been recorded in the repeat dose toxicology studies. Thus, the absence of safety pharmacology studies is endorsed by the CHMP.“
43:
Laut Absatz 4.2.3 - WHO Leitlinie WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 (Seiten 50, 51) sind Genotoxizitätsstudien für endgültige Impfstoffformulierungen normalerweise nicht erforderlich. Der COVID-19 mRNA-Impfstoff von Pfizer/BioNTech ist jedoch der erste seiner Art - Zeit Online: „Nie zuvor ist ein mRNA-Impfstoff zugelassen worden.“ Die Angaben zum Entfall von Studien zur Sicherheitspharmakologie und damit auch zum Entfall von Genotoxizitätsstudien und Karzinogenitätsstudien für endgültige Impfstoffformulierungen, laut WHO, stammen aus dem Jahr 2005, zu diesem Zeitpunkt befanden sich mRNA-Impfstoffe noch in der Erprobungsphase, der Pfizer /BioNTech COVID-19 Impfstoff Comirnaty basiert auf einer völlig neuartigen Impfstoffplattformtechnologie, die noch nie zuvor in einem Impfstoff zur Verabreichung an Menschen Verwendung fand. Warum werden Vorgaben der WHO zu Impfstoffen aus dem Jahr 2005, die aus einer Zeit stammen, in der noch keine, auch nur bedingt zugelassenen mRNA-Impfstoffe, an Menschen verabreicht wurden, im EMA Assessment Report Comirnaty (19.02.2021) (Seite 45), als Bewertungsgrundlage für den neuartigen Pfizer/BioNTech COVID-19 mRNA-Impfstoffs angeführt, da der Antragsteller darauf „verwiesen“ hatte, dass Studien zur Sicherheitspharmakologie laut WHO Leitlinie WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 (Seiten 50, 51) nicht als notwendig erachtet werden, wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
43 a:
Laut EMA Assessment Report (19.02.2021) (Seite 41) wurden mit BNT162b2 auch keine sekundären pharmakodynamischen, oder pharmakodynamischen Arzneimittelwechselwirkungsstudien durchgeführt, da es sich, laut EMA, um ein RNA-basiertes Impfstoffprodukt handelt, das den geltenden Leitlinien, aus dem Jahr 2005 - WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 entspricht, die aus einer Zeit stammen, in der mRNA-Impfstoffe noch in der Erprobung waren und in der noch nicht einmal bedingt zugelassene mRNA-Impfstoffe an Menschen verabreicht wurden. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Art der Vorgehensweise der EMA bei der Bewertung des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty, der auf einer völlig neuartigen Impfstoffplattformtechnologie basiert?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 23): „Novel excipients: Two novel excipients are included in the finished product, the cationic lipid ALC-0315 and the PEGylated lipid ALC-0159. Limited information regarding the novel excipients are provided.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 134): „This vaccine contains two new components (cationic lipid ALC-0315 and PEGylated liquid ALC-0159) in the LNP, for which there is limited experience. Some uncertainties remain regarding the ALC-0315 long half-life.“
44:
Aus der international gültigen Richtlinie zur präklinischen Impfstoffentwicklung der WHO WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 geht unter Absatz 4.2.3 hervor: „4.2.3 Studien zur Genotoxizität und Karzinogenität Genotoxizitätsstudien sind für die endgültige Impfstoffformulierung normalerweise nicht erforderlich. Sie können jedoch für bestimmte Impfstoffkomponenten wie neuartige Adjuvantien und Zusatzstoffe erforderlich sein. Falls erforderlich, sollten die In-vitro-Tests für Mutationen und Chromosomenschäden vor der ersten Exposition gegenüber dem Menschen durchgeführt werden. Die gesamte Testbatterie zur Genotoxizität kann parallel zu den klinischen Versuchen durchgeführt werden (28). Karzinogenitätsstudien sind für Impfstoffantigene nicht erforderlich. Sie können jedoch für bestimmte Impfstoffkomponenten wie neuartige Adjuvantien und Zusatzstoffe erforderlich sein.“ Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 45): „Studien zur Sicherheitspharmakologie: Mit BNT162b2 wurden keine Studien zur Sicherheitspharmakologie durchgeführt.“ Laut EMA Assessment Report Comirnaty 19.02.021 (Seite 45) wurden mit BNT162b2 keine Studien zur Sicherheitspharmakologie durchgeführt. Der Antragsteller „verweist“ darauf, dass diese nach der - WHO - WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005), nicht als notwendig erachtet werden und (Seite 56) daher wurden „gemäß“ den Leitlinien weder Genotoxizitäts- noch Karzinogenitätsstudien durchgeführt, da nicht „erwartet“ wird, dass die Bestandteile des Impfstoffs (Lipide ALC-0315 u. ALC-0159 und mRNA) ein genotoxisches Potenzial haben. Dies war für den CHMP „akzeptabel“. Die WHO erklärt jedoch unter Absatz 4.2.3 in der Leitlinie: WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005, dass Impfstoffe bestimmte Impfstoffkomponenten, wie neuartige Adjuvantien und Zusatzstoffe enthalten können. Falls erforderlich, gibt die WHO zu bedenken, sollten, mit Bezug auf neuartige Adjuvantien und Zusatzstoffe, im Fall des Pfizer/BioNTech COVID-19 mRNA-Impfstoffs Comirnaty wären dies z.B. die neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159, in-vitro-Tests für Mutationen und Chromosomenschäden durchgeführt werden, bevor die erste Exposition gegenüber dem Menschen stattfindet. Der Pfizer/BioNTech COVID-19 Impfstoff enthält die neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159, zu denen, laut EMA Assessment Report Comirnaty (19.02.2021), nur begrenzte Informationen vorgelegt wurden (Seite 23) und zu denen nur begrenzte Erfahrungswerte vorliegen (Seite 134). Laut EMA verbleiben auch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). Wie lautet die Stellungnahme des Bundesministeriums zu diesen Aussagen im EMA Assessment Report Comirnaty (19.02.2021) und zu den Aussagen in der gültigen WHO Leitlinie: WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005, unter Absatz 4.2.3 mit Bezug auf neuartige, pharmazeutische Hilfsstoffe wie ALC-0315 und ALC-0159 in Impfstoffen?
44 a.:
Warum hat die EMA den „Verweis“ EMA Assessment Report Comirnaty (19.02.2021) (Seite 45) des Antragstellers BioNTech mit Bezug auf den Entfall von Studien zur Sicherheitspharmakologie, ein Teil dieser Studien sind Genotoxizitäts- und Karzinogenitätsstudien, akzeptiert. Dieser „Verweis“ betraf nicht nur den Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, sondern auch die neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159. Die WHO erklärt unter Absatz 4.2.3 in der Leitlinie: WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005, dass Impfstoffe bestimmte Impfstoffkomponenten, wie neuartige Adjuvantien und Zusatzstoffe enthalten können. Falls erforderlich, gibt die WHO zu bedenken, sollten, mit Bezug auf neuartige Adjuvantien und Zusatzstoffe in-vitro-Tests für Mutationen und Chromosomenschäden durchgeführt werden, bevor die erste Exposition gegenüber dem Menschen stattfindet. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 41) geht hervor: No secondary pharmacodynamic, safety pharmacology or pharmacodynamic drug interaction studies have been conducted with BNT162b2 due to the nature of the RNA-based vaccine product, which is according to applicable guidelines (WHO guideline on nonclinical evaluation of vaccines, WHO Technical Report Series, No. 927, 2005).
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 50) geht hervor: „Genotoxicity: No genotoxicity studies have been provided. This is acceptable as the components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 55) „No genotoxicity nor carcinogenicity studies have been provided. The components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 56) „As per guidance, no genotoxicity nor carcinogenicity studies were performed. The components of the vaccine (lipids and mRNA) are not expected to have genotoxic potential. This is acceptable to the CHMP.“
Aus dem EMA Dokument: EMA ICH Topic S 2 B - Genotoxicity: A Standard Battery for Genotoxicity Testing of Pharmaceuticals (Seite 3) geht hervor: 2. GENERAL PURPOSE OF GENOTOXICITY TESTING: „Registration of pharmaceuticals requires a comprehensive assessment of their genotoxic potential. It is clear that no single test is capable of detecting all relevant genotoxic agents. Therefore, the usual approach should be to carry out a battery of in vitro and in vivo tests for genotoxicity. Such tests are complementary rather than representing different levels of hierarchy.“
Aus dem EMA Dokument: EMA ICH Topic S 2 B - Genotoxicity: A Standard Battery for Genotoxicity Testing of Pharmaceuticals (Seite 4) geht hervor: „i) A test for gene mutation in bacteria, ii) An in vitro test with cytogenetic evaluation of chromosomal damage with mammalian cells or an in vitro mouse lymphoma tk assay, iii) An in vivo test for chromosomal damage using rodent hematopoietic cells“[26]
45:
Aus der international gültigen Richtlinie zur präklinischen Impfstoffentwicklung der WHO aus dem Jahr 2005 - (WHO guideline on nonclinical evaluation of vaccines, WHO Technical Report Series, No. 927, 2005) geht hervor: "4.2.3 Genotoxizitäts- und Karzinogenitätsstudien: Genotoxizitätsstudien sind normalerweise für die endgültige Impfstoffformulierung nicht erforderlich. Sie können jedoch für bestimmte Impfstoffkomponenten wie neuartige Adjuvantien und Zusatzstoffe erforderlich sein. Falls erforderlich, sollten die In-vitro-Tests für Mutationen und Chromosomenschäden vor der ersten Exposition des Menschen durchgeführt werden. Die gesamte Testbatterie zur Genotoxizität kann parallel zu den klinischen Versuchen durchgeführt werden (28). Karzinogenitätsstudien sind für Impfstoffantigene nicht erforderlich. Sie können jedoch für bestimmte Impfstoffkomponenten wie neuartige Adjuvantien und Zusatzstoffe erforderlich sein.“ Aus dem EMA Dokument: EMA ICH Topic S 2 B - Genotoxicity: A Standard Battery for Genotoxicity Testing of Pharmaceuticals (Seite 4) geht zur Standardbatterie zu Genotoxizitätstests, wie sie von der WHO zu neuartigen, pharmazeutischen Hilfsstoffen in Impfstoffen empfohlen werden, hervor: "i) einen Test auf Genmutation in Bakterien, ii) einen In-vitro-Test mit zytogenetischer Bewertung von Chromosomenschäden mit Säugetierzellen oder einen In-vitro-Maus-Lymphom-tk-Test, iii) einen In-vivo-Test auf Chromosomenschäden mit hämatopoetischen Zellen von Nagetieren". Die von der EMA vorgegebene Standard-Testbatterie zur Genotoxizität umfasst einen Test für Genmutationen in Bakterien, einen In-vitro-Test mit zytogenetischer Bewertung von Chromosomenschäden mit Säugetierzellen oder ein In-vitro-Maus-Lymphom-tk-Assay und einen In-vivo-Test für Chromosomenschäden unter Verwendung hämatopoetischer Zellen von Nagetieren. Laut EMA Assessment Report Comirnaty (19.02.021) (Seite 56) wurden mit Bezug auf die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC.0159 weder Genotoxizitäts- noch Karzinogenitätsstudien durchgeführt, da nicht „erwartet“ wird, dass die Bestandteile des Impfstoffs (Lipide - ALC-0315 und ALC-0159 und mRNA) ein genotoxisches Potenzial haben. Die neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 wurden daher nicht nach der geltenden WHO Richtlinie: WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 Absatz 4.2.3 zu neuartigen, medizinischen Hilfsstoffen mit Bezug auf Genotoxizität oder Karzinogenität, und daher auch nicht nach den Angaben im EMA Dokument: EMA ICH Topic S 2 B - Genotoxicity: A Standard Battery for Genotoxicity Testing of Pharmaceuticals überprüft. Mit Bezug auf die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 wurden daher keine Tests zu Genmutationen in Bakterien, kein In-vitro-Test mit zytogenetischer Bewertung von Chromosomenschäden mit Säugetierzellen, kein In-vitro-Maus-Lymphom-tk-Assay aber auch kein In-vivo-Test für Chromosomenschäden unter Verwendung hämatopoetischer Zellen von Nagetieren durchgeführt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 24) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 hervor: „Lipid related impurities have been observed in some recently manufactured finished product batches, correlated with ALC-0315 lipid batches. The quality of ALC-0315 excipient is considered acceptable based on the available data on condition that specific impurities in the finished product will be further evaluated (SO2).“
Aus dem EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) geht mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 (Seite 6) hervor: „SOB Number: Specific Obligation 2 (SO2), Description (scope): In order to ensure consistent product quality, the MAH should provide additional information to enhance the control strategy, including the active substance and finished product specifications. Due date indicated in Annex II: July 2021, Date of submission: 02/08/2021, Current status: Not Fulfilled“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 41): „No secondary pharmacodynamic, safety pharmacology or pharmacodynamic drug interaction studies have been conducted with BNT162b2 due to the nature of the RNA-based vaccine product, which is according to applicable guidelines (WHO guideline on nonclinical evaluation of vaccines, WHO Technical Report Series, No. 927, 2005).“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 45): „Safety pharmacology studies: No safety pharmacology studies were conducted with BNT162b2. The Applicant refers to that they are not considered necessary according to the WHO guideline (WHO, 2005). In addition, no findings on vital organ functions have been recorded in the repeat dose toxicology studies. Thus, the absence of safety pharmacology studies is endorsed by the CHMP.“
Aus der international gültigen Richtlinie zur präklinischen Impfstoffentwicklung der WHO (WHO Technical Report Series, No. 927, 2005) - Full version of the WHO Technical Report Series N° 927 geht unter Absatz 4.2.3 hervor: „4.2.3 Genotoxicity and carcinogenicity studies Genotoxicity studies are normally not needed for the final vaccine formulation. However, they may be required for particular vaccine components such as novel adjuvants and additives. If needed, the in vitro tests for mutations and chromosomal damage should be done prior to first human exposure. The full battery of tests for genotoxicity may be performed in parallel with clinical trials (28). Carcinogenicity studies are not required for vaccine antigens. However, they may be required for particular vaccine components such as novel adjuvants and additives.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 50) geht hervor: „Genotoxicity: No genotoxicity studies have been provided. This is acceptable as the components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 55) „No genotoxicity nor carcinogenicity studies have been provided. The components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 56) „As per guidance, no genotoxicity nor carcinogenicity studies were performed. The components of the vaccine (lipids and mRNA) are not expected to have genotoxic potential. This is acceptable to the CHMP.“
Aus dem EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) geht hervor: (Seite 35) „Safety pharmacology, genotoxicity and carcinogenicity studies have not been conducted, in accordance with the 2005 WHO vaccine guideline.“
Frage 46: Die Qualität des neuartigen, medizinischen Hilfsstoffs ALC-0315 ist laut EMA nicht akzeptabel, da im EMA Assessment Report Comirnaty (19.02.2021) (Seite 24) vermerkt wurde: „Die Qualität des ALC-0315-Hilfsstoffs wird auf der Grundlage der verfügbaren Daten als akzeptabel angesehen, unter der Bedingung, dass spezifische Verunreinigungen im Endprodukt weiter bewertet werden (SO2).“ Laut EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 6) wurde der aktuelle Status der spezifische Verpflichtung 2 (SO2) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 als „nicht erfüllt“ vermerkt. Somit wird die Qualität des neuartigen, medizinischen Hilfsstoffs funktionelles, kationisches Lipid ALC-0315, laut Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 24), von der EMA, als nicht akzeptabel angesehen. Im EMA Assessment Report Comirnaty (19.02.2021) lauteten die Aussagen zu Sicherheitspharmakologie, mit Bezug auf den Pfizer/BioNTech COVID-19 Impfstoff und mit Bezug auf Studien zur Genotoxizität und Karzinogenität hinsichtlich der neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 wie folgt: (Seite 45): „Mit BNT162b2 wurden keine Studien zur Sicherheitspharmakologie durchgeführt. Der Antragsteller verweist darauf, dass diese nach der WHO-Leitlinie (WHO, 2005) nicht als notwendig erachtet werden.“ und Seite (56) „Den Leitlinien gemäß wurden weder Genotoxizitäts- noch Karzinogenitätsstudien durchgeführt. Es wird nicht erwartet, dass die Bestandteile des Impfstoffs (Lipide und mRNA) ein genotoxisches Potenzial haben. Dies ist für den CHMP akzeptabel." Im EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) (Seite 35) lauten die Aussagen zu Sicherheitspharmakologie, Genotoxizität und Karzinogenität wie folgt: „Studien zur Sicherheitspharmakologie, Genotoxizität und Karzinogenitätsstudien wurden nicht durchgeführt, gemäß der WHO-Impfstoffrichtlinie von 2005. Leitlinie, 88“ und Seite (37) „a. Studien zur Sicherheitspharmakologie, Genotoxizität und Karzinogenität wurden gemäß den WHO-Impfstoffrichtlinien von 2005 nicht durchgeführt, da sie im Allgemeinen nicht als notwendig erachtet werden, um die Entwicklung und Zulassung von Impfstoffen gegen Infektionskrankheiten zu unterstützen.88 Darüber hinaus handelt es sich bei den Bestandteilen des Impfstoffkonstrukts um Lipide und RNA, von denen kein karzinogenes oder genotoxisches Potenzial erwartet wird.“ Die WHO erklärt jedoch in der Leitlinie: WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 unter Absatz 4.2.3.: "Genotoxizitäts- und Karzinogenitätsstudien Genotoxizitätsstudien sind normalerweise für die endgültige Impfstoffformulierung nicht erforderlich. Sie können jedoch für bestimmte Impfstoffkomponenten wie neuartige Adjuvantien und Zusatzstoffe erforderlich sein. Falls erforderlich, sollten die In-vitro-Tests für Mutationen und Chromosomenschäden vor der ersten Exposition gegenüber dem Menschen durchgeführt werden. Die gesamte Testbatterie zur Genotoxizität kann parallel zu den klinischen Versuchen durchgeführt werden (28). Karzinogenitätsstudien sind für Impfstoffantigene nicht erforderlich. Sie können jedoch für bestimmte Impfstoffkomponenten wie neuartige Adjuvantien und Zusatzstoffe erforderlich sein.“ Die Qualität des neuartigen, medinischen Hilfsstoffs ALC-0315 ist laut EMA nicht akzeptabel, da der aktuelle Status der spezifische Verpflichtung 2 (SO2) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.202)1 (Seite 6) mit „nicht erfüllt“ vermerkt wurde. Mit Bezug auf den Entfall von Studien zur Genotoxizität und Karzinogenität, hinsichtlich der neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 beruft sich die EMA auf die WHO Leitlinie: WHO guideline on nonclinical evaluation of vaccines, WHO Technical Report Series, No. 927, 2005 erwähnt aber nicht, dass laut WHO, Genotoxizitäts- und Karzinogenitätsstudien zwar nicht für endgültige Impfstoffformulierungen erforderlich sind, jedoch sehr wohl für neuartige pharmazeutische Hilfsstoffe, wie ALC-0315 und ALC-0159, erforderlich sein können. Der Entfall der Studien zur Genotoxizität und Karzinogenität, zu den neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 ist keine Vorgehensweise, die als „gemäß“ WHO Leitlinie (WHO Technical Report Series, No. 927, 2005) bezeichnet werden kann. Mit Bezug auf das Genotoxizitäts- und Karzinogenitätsrisiko hinsichtlich der neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 geht die EMA im Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) immer noch von einer „Erwartungshaltung“ aus und führt keinerlei Daten oder Studienergebnisse an die, die völlige Unbedenklichkeit der Verwendung der neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff bestätigen. Wie lautet die Stellungnahme des Bundesministeriums zu den oben angeführten Angaben der EMA mit Bezug auf Genotoxiziät und Karzinogenität hinsichtlich der neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159, im EMA Assessment Report Comirnaty (19.02.2021 )(Seiten 24, 56), im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty 14.10.2021 (Seite 6), im EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan 25.11.2021 (Seiten 35, 37) und dem Widerspruch dieser Angaben zu den Ausführungen der WHO zu neuartigen, medizinischen Hilfsstoffen in der WHO Leitlinie: WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 Absatz 4.2.3?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 41): “No secondary pharmacodynamic, safety pharmacology or pharmacodynamic drug interaction studies have been conducted with BNT162b2 due to the nature of the RNA-based vaccine product, which is according to applicable guidelines (WHO guideline on nonclinical evaluation of vaccines, WHO Technical Report Series, No. 927, 2005).”
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 45) geht hervor: „Safety pharmacology studies: No safety pharmacology studies were conducted with BNT162b2. The Applicant refers to that they are not considered necessary according to the WHO guideline (WHO, 2005). In addition, no findings on vital organ functions have been recorded in the repeat dose toxicology studies. Thus, the absence of safety pharmacology studies is endorsed by the CHMP.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 50) geht hervor: „Genotoxicity: No genotoxicity studies have been provided. This is acceptable as the components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 55) „No genotoxicity nor carcinogenicity studies have been provided. The components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 56) „As per guidance, no genotoxicity nor carcinogenicity studies were performed. The components of the vaccine (lipids and mRNA) are not expected to have genotoxic potential. This is acceptable to the CHMP.“
Aus dem EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) geht hervor: (Seite 35) „Safety pharmacology, genotoxicity and carcinogenicity studies have not been conducted, in accordance with the 2005 WHO vaccine guideline.“
Aus dem EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan ( 25.11.2021) geht hervor: (Seite 37) „a. Safety pharmacology, genotoxicity, and carcinogenicity studies were not conducted, in accordance with 2005 WHO vaccine guideline, as they are generally not considered necessary to support development and licensure of vaccines for infectious diseases.88 In addition, the components of the vaccine construct are lipids and RNA and are not expected to have carcinogenic or genotoxic potential.“
47:
Laut EMA Assessment Report (19.02.2021) (Seite 45) wurden mit BNT162b2 keine Studien zur Sicherheitspharmakologie, durchgeführt. Auch aus dem EMA Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) Seite (35) hervor, dass mit BNT162b2 Comirnaty keine Studien zur Sicherheitspharmakologie durchgeführt wurden. Laut Eupati zeigen Studien zur Sicherheitspharmakologie, ob damit zu rechnen ist, dass sich ein Arzneimittel bei Verabreichung an Menschen im therapeutischen Bereich als unsicher herausstellt. Durch Studien zur Sicherheitspharmakologie soll die Verwendung unsicherer Arzneimittel verhindert werden. Warum wird der Pfizer/BioNTech COVID-19 Impfstoff, trotz des Entfalls von Studien zur Sicherheitspharmakologie als sicher bezeichnet?
48:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) handelt es sich bei den Bestandteilen der Impfstoffformulierung um Lipide (ALC-0315 und ALC-0159) und RNA, bei denen kein genotoxisches Potenzial zu „erwarten“ ist. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 56) wurden „gemäß“ den Leitlinien, mit Bezug auf die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 keine Genotoxizitätsstudien durchgeführt oder vorgelegt. Auch aus dem EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) (Seiten 35, 37) geht hervor, dass keine Studien zur Genotoxizität durchgeführt wurden. Als Genotoxizität oder Mutagenität bezeichnet man die mutagenen Wirkungen von chemischen Stoffen, die Änderungen im genetischen Material von Zellen auslösen. Die Bestimmung der Genotoxizität eines Stoffes ist Teil der Toxizitätsbestimmung eines Stoffes. Aus der international gültigen Richtlinie zur präklinischen Impfstoffentwicklung der WHO WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 4.2.3 geht hervor: "4.2.3 Genotoxizitäts- und Karzinogenitätsstudien: Genotoxizitätsstudien sind normalerweise für die endgültige Impfstoffformulierung nicht erforderlich. Sie können jedoch für bestimmte Impfstoffkomponenten wie neuartige Adjuvantien und Zusatzstoffe erforderlich sein. Falls erforderlich, sollten die In-vitro-Tests für Mutationen und Chromosomenschäden vor der ersten Exposition gegenüber dem Menschen durchgeführt werden.“ Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 56) wurden keine Studien zur Genotoxizität mit Bezug auf die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 durchgeführt oder vorgelegt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Auch aus dem EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) (Seiten 35, 37) geht hervor, dass keine Studien zur Genotoxizität durchgeführt wurden, „gemäß“ den WHO-Impfstoffrichtlinien von 2005. Warum wird der Pfizer/BioNTech COVID-19 Impfstoff trotz des Entfalls von Studien zur Genotoxizität mit Bezug auf den neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315 als sicher bezeichnet?
48 a.:
Warum beruft sich die EMA mit Bezug auf den Entfall von Genotoxizitätsstudien hinsichtlich der neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 auf die international gültige Richtlinie zur präklinischen Impfstoffentwicklung WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 wenn unter Absatz 4.2.3 mit Bezug auf neuartige, medizinische Hilfsstoffe die Durchführung von Studien zur Genotoxizität empfohlen werden?
49:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) handelt es sich bei den Bestandteilen der Impfstoffformulierung um Lipide (ALC-0315 und ALC-0159) und RNA, bei denen kein karzinogenes Potenzial zu „erwarten“ ist. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 56) wurden „gemäß“ den Leitlinien, mit Bezug auf die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 keine Karzinogenitätsstudien durchgeführt. Aufgrund ihrer toxischen Wirkungen wird zwischen genotoxischen und nicht-genotoxischen Kanzerogenen unterschieden. Genotoxische Kanzerogene reagieren direkt mit der DNA der Zelle, wodurch es am Ende zu einer Mutation kommt. Nicht-genotoxische Substanzen wirken über sekundäre Mechanismen, die keine direkte Interaktion mit der DNA auslösen. Sie lösen keine kurzfristigen Mutationen in eukaryotischen und prokaryotischen Mutationstests aus und induzieren auch keine direkten DNA-Schäden im Zielorgan. Sie können demnach über Genotoxizitätstests nicht erkannt werden. Nicht-genotoxische Karzinogene umfassen auch epigenetische Veränderungen. Sie reagieren z. B. auch mit Proteinen oder Immunzellen. Kationische Lipide, wie ALC-0315, können die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies stimulieren Xucheng Hou et al. (Dezember 2021). Ein erhöhtes Niveau an reaktiven Sauerstoffspezies in Körperzellen verursacht die Entstehung von oxidativem Stress im menschlichen Organismus Michael Schieber et al. (2014). Oxidativer Stress spielt eine wesentliche Rolle bei der Entstehung chronischer Krankheiten wie z.B. Krebs. Mehdi Sharifi-Rad et al. (2020). Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden keine Studien zur Karzinogenität mit Bezug auf die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 durchgeführt oder vorgelegt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Aus der international gültigen Richtlinie zur präklinischen Impfstoffentwicklung der WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 Absatz 4.2.3 geht hervor: "4.2.3 Genotoxizitäts- und Karzinogenitätsstudien Genotoxizitätsstudien sind normalerweise für die endgültige Impfstoffformulierung nicht erforderlich. Sie können jedoch für bestimmte Impfstoffkomponenten wie neuartige Adjuvantien und Zusatzstoffe erforderlich sein. Falls erforderlich, sollten die In-vitro-Tests für Mutationen und Chromosomenschäden vor der ersten Exposition gegenüber dem Menschen durchgeführt werden.“ Auch aus dem EMA Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) geht auf (Seiten 35, 37) ebenfalls hervor, dass keine Studien zur Karzinogenität durchgeführt wurden. Der Entfall von Karzinogenitätsstudien, vor allem mit Bezug auf den neuartigen, medizinischen Hilfsstoff ALC-0315, stellt ein Sicherheitsproblem dar. Warum wird der Pfizer/BioNTech COVID-19 Impfstoff trotz des Entfalls von Studien zur Karzinogenität mit Bezug auf den neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315 als sicher bezeichnet?
49 a.:
Warum beruft sich die EMA mit Bezug auf den Entfall zu Karzinogentätsstudien hinsichtlich der neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 auf die international gültige Leitlinie zur präklinischen Impfstoffentwicklung der WHO WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005, wenn unter Absatz 4.2.3 mit Bezug auf neuartige, medizinische Hilfsstoffe die Durchführung von Studien zur Karzinogenitität empfohlen wird?
Aus dem EMA: Comirnaty Risk Management Plan (25.11.2021) geht hervor: (Seite 35) „COVID-19 mRNA vaccine (V9) was evaluated clinically and submitted for application. Two GLP-compliant repeat-dose toxicity studies were performed in Wistar Han rats; one with each variant. Both studies were 17 days in duration with a 3-week recovery period. A DART study in Wistar Han rats has been completed. Safety pharmacology, genotoxicity and carcinogenicity studies have not been conducted, in accordance with the 2005 WHO vaccine guideline.“
Aus dem EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) (Seite 99) geht hervor: „The vaccine construct and the formulation. The COVID-19 mRNA vaccine consists of non-infectious, non-replicating RNA in a lipid-based formulation, which delivers the RNA to cells in the immunised person. Protein expression from the RNA is transient, and as is RNA itself. There is no systemic toxicity associated with the LNP or ist metabolism (Study reports 38166 and 20GR142). Vacuolation of hepatocytes was observed in rat toxicity studies and believed to be associated with the uptake of the LNP and was without evidence of any effect on liver function.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 23): „Novel excipients Two novel excipients are included in the finished product, the cationic lipid ALC-0315 and the PEGylated lipid ALC-0159. Limited information regarding the novel excipients are provided.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 55): „No genotoxicity nor carcinogenicity studies have been provided. The components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) geht hervor: „While there was no detectable excretion of either lipid in the urine, the percent of dose excreted unchanged in faeces was ~1% for ALC-0315 and ~50% for ALC-0159. Since almost no unchanged ALC-3015 was detected in urine or faeces, metabolism may play a bigger role in the elimination of ALC-0315 than ALC-0159.“
Aus dem EMA Dokument: ICH Topic S 4 Duration of Chronic Toxicity Testing in Animals (Rodent and Non Rodent Toxicity Testing) geht hervor: „Guidance on duration of chronic toxicity testing for tripartite development plan Arising from the extensive analysis and review of the above mentioned data in non-rodents and based upon the achievements of ICH1 for testing in rodents, and so as to avoid duplication and follow a single development plan for chronic toxicity testing of new medicinal products, the following studies are considered acceptable for submission in the 3 regions: 1. Rodents A study of 6 months duration. 2. Non-Rodents A study of 9 months duration.“ [27]
50:
Laut EMA Comirnaty Risk Management Plan (25.11.2021) Comirnaty (Seite 35) wurden zwar zwei, laut EMA, GLP-konforme Studien zur Toxizität bei wiederholter Verabreichung an Wistar-Han-Ratten durchgeführt, beide Studien hatten jedoch nur eine Dauer von 17 Tagen mit einer 3-wöchigen Erholungsphase - Studien 38166 und 20GR142. Innerhalb der kurzen Zeitdauer von ca. einem Monat wurde, laut EMA, keine systemische Toxizität im Zusammenhang mit den Lipidnanopartikeln oder deren Metabolismus festgestellt (Seit 99). Der Pfizer/BioNTech COVID-19 Impfstoff enthält jedoch die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159, zu denen, laut EMA Assessment Report Comirnaty (19.02.2021), (Seite 23) nur begrenzte Informationen vorgelegt wurden. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) wurden vom Antragsteller keine Studien zur Genotoxizität oder Karzinogenität durchgeführt, da es sich bei den Bestandteilen der Impfstoffformulierung, um Lipide (ALC-0315 u. ALC-0159) und RNA handelt, bei denen, laut EMA, kein genotoxisches Potenzial zu „erwarten“ ist und zu denen nur begrenzte Erfahrungswerte vorliegen (Seite 134). Laut EMA verbleiben auch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). (Seite 48) Der Prozentsatz der unverändert mit den Fäkalien, der Versuchstiere, ausgeschiedenen Dosis betrug ~1% für ALC-0315 und ~50% für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien nachgewiesen wurde, „könnte“ der Stoffwechsel, laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48), eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Mit Bezug auf die Ausscheidung von ALC-0315 äußert die EMA eine Vermutung. Eine Vermutung ist kein wissenschaftlicher Beweis, der auf zuverlässigen, wissenschaftlichen Daten basiert. Laut EMA Dokument: ICH Topic S 4 Duration of Chronic Toxicity Testing in Animals (Rodent and Non Rodent Toxicity Testing haben Studien zur Untersuchung der chronischen Toxizität jedoch eine Dauer von 6 Monaten bei Nagetieren und 9 Monate bei Nichtnagetieren. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
50 a.:
Wie lautet die Stellungnahme des Bundesministeriums mit Bezug auf die äußerst kurze Zeitdauer der Studien 38166 und 20GR142 zur Toxizität von 17 Tagen + 3 Wochen Erholungsphase mit Bezug auf die Sicherheit des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty?
50 b.:
Aus welchen Studien, Risikobewertungen und Dokumenten der Impfstoffhersteller BioNTech - Pfizer Inc. geht hervor, dass mit Toxizitätsstudien, die eine Zeitdauer von nur 17 Tagen + 3 Wochen Erholungsphase umfassten, die völlige Unbedenklichkeit des neuartigen, medizinischen Hilfsstoffs ALC-0315, aber auch des neuartigen, medizinischen Hilfsstoffs ALC-0159 einwandfrei und lückenlos belegt werden kann?
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) betrug der Prozentsatz, der unverändert mit den Fäkalien, von den Versuchstiere, ausgeschiedenen Dosis ~1% für ALC-0315 und ~50% für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien nachgewiesen wurde, „könnte“ der Stoffwechsel, laut EMA, eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Laut EMA verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). Die Halbwertszeit von ALC-0315 ist nicht geklärt und es ist nicht bekannt, für welchen Zeitraum ALC-0315 im Organismus verbleibt, wie konnte aufgrund dieser Tatsachen, eine umfassende Risikobewertung des neuartigen, medizinischen Hilfsstoffs ALC-0315 durchgeführt werden, wenn die Studien zur Toxizität laut EMA Comirnaty Risk Management Plan (25.11.2021) (Seite 35) nur eine Zeitdauer von 17 Tagen + 3 Wochen Erholungsphase hatten?
50 d.:
Laut EMA Dokument: ICH Topic S 4 Duration of Chronic Toxicity Testing in Animals (Rodent and Non Rodent Toxicity Testing haben Studien zur Untersuchung der chronischen Toxizität eine Dauer von 6 Monaten bei Nagetieren und 9 Monate bei Nichtnagetieren. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) betrug der Prozentsatz der unverändert mit den Fäkalien, der Versuchstiere, ausgeschiedenen Dosis ~1% für ALC-0315 und ~50% für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien nachgewiesen wurde, „könnte“ der Stoffwechsel, laut EMA, eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Laut EMA verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134). Die Halbwertszeit von ALC-0315 ist nicht geklärt und es ist nicht bekannt für welchen Zeitraum ALC-0315 im Organismus verbleibt. Warum wurden keine Studien zur chronischen Toxizität zur Risikobewertung des neuartigen, medizinischen Hilfsstoffs ALC-0315 durchgeführt?
Aus dem EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan 25.11.2021 geht hervor: (Seite 35) “COVID-19 mRNA vaccine (V9) was evaluated clinically and submitted for application. Two GLP-compliant repeat-dose toxicity studies were performed in Wistar Han rats; one with each variant. Both studies were 17 days in duration with a 3-week recovery period. A DART study in Wistar Han rats has been completed. Safety pharmacology, genotoxicity and carcinogenicity studies have not been conducted, in accordance with the 2005 WHO vaccine guideline.“
Aus der international gültigen Richtlinie zur präklinischen Impfstoffentwicklung der WHO (WHO Technical Report Series, No. 927, 2005) - Full version of the WHO Technical Report Series N° 927 geht unter Absatz 4.2.3 hervor: „4.2.3 Genotoxicity and carcinogenicity studies Genotoxicity studies are normally not needed for the final vaccine formulation. However, they may be required for particular vaccine components such as novel adjuvants and additives. If needed, the in vitro tests for mutations and chromosomal damage should be done prior to first human exposure. The full battery of tests for genotoxicity may be performed in parallel with clinical trials (28). Carcinogenicity studies are not required for vaccine antigens. However, they may be required for particular vaccine components such as novel adjuvants and additives.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 55): „No genotoxicity nor carcinogenicity studies have been provided. The components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 45): „Safety pharmacology studies: No safety pharmacology studies were conducted with BNT162b2. The Applicant refers to that they are not considered necessary according to the WHO guideline (WHO, 2005). In addition, no findings on vital organ functions have been recorded in the repeat dose toxicology studies. Thus, the absence of safety pharmacology studies is endorsed by the CHMP.“
Aus dem EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) geht hervor: (Seite 35) „COVID-19 mRNA vaccine (V9) was evaluated clinically and submitted for application. Two GLP-compliant repeat-dose toxicity studies were performed in Wistar Han rats; one with each variant. Both studies were 17 days in duration with a 3-week recovery period. A DART study in Wistar Han rats has been completed. Safety pharmacology, genotoxicity and carcinogenicity studies have not been conducted, in accordance with the 2005 WHO vaccine guideline.“
51:
Laut Assessment Report Comirnaty (19.02.2021) (Seite 45): wurden mit BNT162b2 keine Studien zur Sicherheitspharmakologie durchgeführt. Der Antragsteller „verwies“ darauf, dass diese nach der WHO-Leitlinie (WHO, 2005) nicht als notwendig erachtet werden. Ein Teil der Studien zur Sicherheitspharmakologie sind Studien zur Genotoxizität und Karzinogenität, die mit Bezug auf die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 nicht durchgeführt wurden. Der Antragsteller hatte nicht darauf „verwiesen“, dass laut WHO guideline on nonclinical evaluation of vaccines, WHO Technical Report Series, No. 927, 2005 Absatz 4.2.3 Genotoxizitäts- und Karzinogenitätsstudien für bestimmte Impfstoffkomponenten wie neuartige Adjuvantien und Zusatzstoffe erforderlich sein können, falls erforderlich, so die WHO, sollten die In-vitro-Tests für Mutationen und Chromosomenschäden vor der ersten Exposition gegenüber dem Menschen durchgeführt werden. Darüber hinaus, so die EMA, wurden in den Toxikologiestudien mit wiederholter Verabreichung keine Befunde zu lebenswichtigen Organfunktionen erhoben. Diese Toxikologiestudien hatten laut EMA Comirnaty Risk Management Plan (25.11.2021) (Seite 35) aber nur die Zeitspanne von 17 Tagen + 3 Wochen Erholungsphase. Studien zur chronischen Toxizität wurden Zeitdauer 6 Monate bei Nagetieren und 9 Monate bei Nichtnagetieren wurden nicht durchgeführt und wie schon erwähnt Studien zur Genotoxizität und Karzinogenität ebenfalls nicht. Der Entfall von Studien zur Genotoxizität und Karzinogenität mit Bezug auf, vor allem ALC-0315, aber auch ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff ist eine Tatsache, die schwere Folgen haben wird oder vielleicht schon hat. Kationische Lipide, wie ALC-0315, können die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies stimulieren Xucheng Hou et al. (Dezember 2021) Ein erhöhtes Niveau an reaktiven Sauerstoffspezies in Körperzellen verursacht die Entstehung von oxidativem Stress im menschlichen Organismus Michael Schieber et al. (2014). Oxidativer Stress spielt eine wesentliche Rolle bei der Entstehung chronischer Krankheiten wie z.B. Krebs. Mehdi Sharifi-Rad et al. (2020). Über diese Form der Toxizität, die durch kationische Lipide, wie ALC-0315, verursacht werden kann, werden im EMA Comirnaty Risk Management Plan (25.11.2021) keine Angaben gemacht. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Wurde das Risiko der Zytotoxizität, die durch kationische Lipide, wie ALC-0315, durch die Stimulation von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies verursacht wird, von den Impfstoffherstellern BioNTech - Pfizer Inc. im Rahmen der Risikobewertungen im EMA Comirnaty Risk Management Plan (25.11.2021) überhaupt untersucht, wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Aus dem Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) (Seite 99) geht hervor: „The vaccine construct and the formulation. The COVID-19 mRNA vaccine consists of non-infectious, non-replicating RNA in a lipid-based formulation, which delivers the RNA to cells in the immunised person. Protein expression from the RNA is transient, and as is RNA itself. There is no systemic toxicity associated with the LNP or ist metabolism (Study reports 38166 and 20GR142). Vacuolation of hepatocytes was observed in rat toxicity studies and believed to be associated with the uptake of the LNP and was without evidence of any effect on liver function. The liver vacuolation was reversed approximately 3-weeks after the last administration.“
Aus dem EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) (Seite 34) geht hervor: „A GLP DART study has been completed. No additional toxicity studies are planned for COVID-19 mRNA vaccine.“ und (Seite 37) „Key Safety findings from Nonclinical Studies: „Developmental and Reproductive Toxicity: No vaccine-related effects on female fertility or the development of fetuses or offspring were observed in a DART study of COVID-19 mRNA vaccine in rats. Relevance to Human Usage: No effects are anticipated in WOCBP - women of child-bearing potential, pregnant women or their offspring.“
Aus der Studie von Aleisha R. Brock et al. (Oktober 2021): Spontaneous Abortions and Policies on COVID-19 mRNA Vaccine Use During Pregnancy (Seite 135) geht zu den Pfizer/BioNTech Fertilitätsstudien mit Ratten hervor: „The Pfizer-BioNTech study of rats was reported to indicate no issues in fertility of the exposed animals or their pups. However, more careful scrutiny of the study indicates an increase (approximately 2 times) of pre-implantation loss (9.77 % compared to 4.09 % in the control group), but findings were reported to be within historical control data ranges (5.1–11.5 %). There was additionally a low incidence of gastroschisis, mouth/jaw malformations, right-sided aortic arch and cervical vertebrae abnormalities in fetuses, once again reported to be within the range of historical control data. The study did not assess placental transfer of BNT162b2 mRNA.[23]“
52:
Laut EMA Comirnaty Risk Management Plan (25.11.2021) (Seite 34) wurde eine GLP-DART-Studie abgeschlossen. Es sind keine weiteren Toxizitätsstudien mit Bezug auf den COVID-19 mRNA-Impfstoff geplant. Zu den wichtigen Sicherheitsergebnisse aus nichtklinischen Studien - Entwicklungs- und Reproduktionstoxizität wird angeführt (Seite 37): „In einer DART-Studie mit COVID-19 mRNA-Impfstoff an Ratten wurden keine impfstoffbezogenen Auswirkungen auf die weibliche Fruchtbarkeit oder die Entwicklung von Föten oder Nachkommen beobachtet. Relevanz für die Anwendung beim Menschen: Es sind keine Auswirkungen auf Frauen im gebärfähigen Alter, schwangere Frauen oder deren Nachkommen zu erwarten.“ Laut Angaben Aleisha R. Brock et al (Oktober 2021) (Seite 135) deutete eine genauere Untersuchung der Pfizer/BioNTech DART Studie jedoch auf einen Anstieg (etwa das Zweifache) der Präimplantationsverluste hin (9,77 % im Vergleich zu 4,09 % in der Kontrollgruppe), aber die Ergebnisse lagen den Berichten zufolge innerhalb der historischen Kontrolldaten (5,1-11,5 %) (Seite 135). Wie lautet die Stellungnahme des Bundesministeriums, können Präimplantationsverluste nach der Verabreichung von Pfizer/BioNTech Comirnaty an Menschen gänzlich ausgeschlossen werden?
52 a.:
Laut Angaben Aleisha R. Brock et al. (Oktober 2021) (Seite 135) gab es geringe Indizien für Gastroschisis, Mund-/Kieferfehlbildungen, rechtsseitigem Aortenbogen und Anomalien der Halswirbelsäule in den Föten der Versuchstiere. Wie lautet die Stellungnahme des Bundesministeriums, kann gänzlich ausgeschlossen werden, dass die Verabreichung von Pfizer/BioNTech Comirnaty die beschriebenen Missbildungen in menschlichen Föten nicht verursacht?
52 b.:
Laut Angaben Aleisha R. Brock et al. (Oktober 2021) (Seite 135) wurde in der Pfizer/BioNTech DART-Studie, die auch im EMA Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan 25.11.2021 angegeben wurde, der plazentare Transfer von mRNA im Pfizer/BioNTech COVID-19 Impfstoff nicht untersucht. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt, warum wurde dies von den Impfstoffherstellern BioNTech - Pfizer Inc. nicht untersucht?
Aus der Studie von Aleisha R. Brock et al. (Oktober 2021): Spontaneous Abortions and Policies on COVID-19 mRNA Vaccine Use During Pregnancy (Seite 136) geht zu den Pfizer/BioNTech Fertilitätsstudien mit Ratten hervor: „Inhibition of Synctyin-1. Other mechanisms which may be disrupted by the injection include syncytin-1 (syn1), a fusogenic protein of retroviral origin, essential for cell fusion and placental development.[27] Studies are required to determine if mRNA encoded spike (S) protein HR1 (or HR1a28) or HR2 has the ability to inadvertently inhibit syn1, preventing the cell fusion required for placental attachment, resulting in pregnancy loss. The rodent studies carried out by Pfizer and Moderna to determine if there could be an impact on fertility and development may need to be repeated in Old World primates, such as macaques, as they have similar syn1 and syn2 proteins to humans, whereas rats do not. The presence of autoantibodies to syn1 was investigated by Mattar et al., and although a change from baseline of autoantibodies to syn1 occurred in all 15 pregnant women exposed to the first dose of the Pfizer-BioNTech product, the change was not deemed high enough to be considered biologically significant.[25] Given the small sample size, these findings may indicate that further investigation is required. Further, an altered syn1 expression is associated with pre-eclampsia, hemolysis, elevated liver enzymes and low platelets syndrome, intrauterine growth restriction and gestational diabetes mellitus in observational studies.[29–31]
Synctyin-1 is also required for gamete fusion (syn1 and ACET2 receptors present in sperm [32] and oocytes [33]) and, additionally, found in the testes34 and ovaries.[33,35] In the Comirnaty (Pfizer/BioNTech mRNA vaccine) Package Insert submitted to the Food and Drug Administration (FDA), the manufacturers state that potential impairment of male fertility has not been evaluated (page 15).[36] A single-center prospective study was carried out on the impact of mRNA vaccination on sperm number and motility in 45 men prior to mRNA vaccination exposure (following 2–7 days abstinence), and again 70 days post-exposure to the second vaccination. No significant negative impacts on sperm parameters were reported; however, the study did not assess the fusogenic potential (syn1 is in the acrosome of the sperm head) or synctyin antibody levels in this cohort and is recommended for further research.[37]“[28]
53:
Laut Angaben Aleisha R. Brock et al. (Oktober 2021) (Seite 136) sind Studien erforderlich um festzustellen, ob das mRNA-kodierte Spike-(S)-Protein nach der Verabreichung von Pfizer/BioNTech Comirnaty die Fähigkeit besitzt Syncytin-1 zu hemmen und damit die, für die Plazentaanhaftung erforderliche Zellfusion verhindern könnte, was zu einem Schwangerschaftsverlust führen kann. Über diese Form der Toxizität, die durch kationische Lipide, wie ALC-0315, verursacht werden kann, sind im EMA Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) keine Angaben zu finden. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
53 a.:
Laut Angaben von R. Tenchov et al. (Juni 2021) können kationische Lipide, wie ALC-0315, die Mitose in Zellen reduzieren. Die Folge einer Mitosehemmung sind polyploide Zellkerne, in denen ein vielfacher Chromosomensatz vorliegt, z. B. ein dreifacher oder ein vierfacher Chromosomensatz. Für den Menschen ist Polyploidie tödlich: Neugeborene, die aufgrund einer fehlerhaften Zellteilung im frühen Entwicklungsstadium oder wegen eines defekten Spermiums oder Eizelle mit dreifachem Chromosomensatz (Triploidie) zur Welt kommen, sterben meist bei der Geburt oder werden tot geboren. Über diese Form der Toxizität, die durch kationische Lipide, wie ALC-0315, verursacht werden kann, sind im EMA Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) keine Angaben zu finden. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 50) geht hervor: „The novel excipient ALC-0159 contains a potential acetamide moiety. Risk assessment performed by the Applicant indicates that the risk of genotoxicity relating to this excipient is very low based on literature data where acetamide genotoxicity is associated with high doses and chronic administration (≥1000 mg/kg/day). Since the amount of ALC-0159 excipient in the finished product is low (50 µg/dose), its clearance is high and only two administrations of the product are recommended for humans, the genotoxicity risk is expected to be very low.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 45) geht hervor: „In study PF-07302048_06Jul20_072424, the applicant has used a qualified LC-MS/MS method to support quantitation of the two novel LNP excipients. The bioanalysis methods appear to be adequately characterized and validated for use in the GLP studies.“
54:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 45) hat der Antragsteller in der Studie PF-07302048_06Jul20_072424 eine qualifizierte LC-MS/MS-Methode verwendet, um die Quantifizierung der beiden neuartigen LNP-Hilfsstoffe (ALC-0315 und ALC-0315) zu unterstützen. Laut EMA hat es jedoch nur den „Anschein“, dass Bioanalysemethoden für die Verwendung in den Good Laboratory Practice-Studien vom Antragsteller angemessen beschrieben und validiert wurden. Wenn etwas den „Anschein“ hat, ist das kein wissenschaftlicher Beweis. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage im EMA Assessment Report Comirnaty (19.02.2021) (Seite 45)?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) geht hervor: „Following plasma clearance, the liver appears to be to major organ to which ALC-0315 and ALC-0159 distribute. The applicant has estimated the percent of dose distributed to the liver to be ~60 % for ALC0315 and ~20 % for ALC-0159. The observed liver distribution is consistent with the observations from the biodistribution study and the repeat-dose toxicology, both using IM administration.“
55:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) „scheint“ es so, dass nach der Plasma-Clearance die Leber das Hauptorgan ist, an das sich ALC-0315 und ALC-0159 verteilen. Der Antragsteller „schätzt“ den Prozentsatz, der in der Leber verteilten Dosis auf ~60 % für ALC-0315 und ~20 % für ALC-0159. Mit Bezug auf die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 „scheint“ der EMA etwas so zu sein. Das ist keine Angabe, die auf eindeutigen, wissenschaftlichen Fakten beruht. Sie ist eine Vermutung. Die Schätzung des Antragstellers ist keine präzise Angabe. Wie lautet die Stellungnahme des Bundesministeriums zu diesen Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 46)?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) geht hervor: „The applicant was asked to discuss the long half-life of ALC-0315 and its effect, discussion on the comparison with patisiran, as well as the impact on the boosts and post treatment contraception duration. The applicant considered that there were no non-clinical safety issues based on the repeat dose toxicity studies at doses (on a mg/kg basis) much greater than administered to humans; this was acceptable to the CHMP.“
56:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) wurde der Antragsteller gebeten, die lange Halbwertszeit von ALC-0315 und dessen Wirkung, den Vergleich mit Patisiran, sowie die Auswirkungen auf die Boosts und die Dauer der Empfängnisverhütung nach der Behandlung zu erörtern. Der Antragsteller war der „Auffassung“, dass es auf der Grundlage der von ihm durchgeführten Studien zur Toxizität, bei wiederholter Verabreichung in Dosen (auf mg/kg-Basis), die weit über den beim Menschen verabreichten liegen, keine nichtklinischen Sicherheitsprobleme gäbe und diese „Auffassung“ des Antragstellers hat die EMA akzeptiert. Eine „Auffassung“ ist eine persönliche Ansicht, aber kein wissenschaftlicher Beweis. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage im EMA Assessment Report Comirnaty (19.02.2021) (Seite 46)?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) geht hervor: „While there was no detectable excretion of either lipid in the urine, the percent of dose excreted unchanged in faeces was ~1 % for ALC-0315 and ~50 % for ALC-0159. Since almost no unchanged ALC-3015 was detected in urine or faeces, metabolism may play a bigger role in the elimination of ALC-0315 than ALC-0159.“
57:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) betrug der Prozentsatz der unverändert mit den Fäkalien ausgeschiedenen Dosis ~1 % für ALC-0315 und ~50 % für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien nachgewiesen wurde, „könnte“ der Stoffwechsel laut EMA eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Mit Bezug auf die Ausscheidung von ALC-0315 äußert die EMA eine Vermutung. Eine Vermutung ist kein wissenschaftlicher Beweis, der auf zuverlässigen, wissenschaftlichen Daten basiert.Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage im EMA Assessment Report Comirnaty (19.02.2021) (Seite 48)?
Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315, die Sekretion von reaktiven Sauerstoffspezies stimulieren. Laut Angaben Michael Schieber et al. (2014) entsteht oxidativer Stress aus einem erhöhten Spiegel an reaktiven Sauerstoffspezies innerhalb der menschlichen Zellen. Laut Angaben Mehdi Sharifi-Rad et al. (2020) spielt oxidativer Stress eine wesentliche Rolle bei der Entstehung chronischer Krankheiten wie Krebs, Herz-Kreislauf-Erkrankungen, Diabetes und neurodegenerativen Erkrankungen. Eine langfristige Exposition gegenüber erhöhten Konzentrationen von pro-oxidativen Faktoren kann strukturelle Defekte auf der Ebene der mitochondrialen DNA führen, sowie funktionelle Veränderungen verschiedener Enzyme und zellulärer Strukturen verursachen, die zu Abweichungen in der Genexpression führen. Defekte der Mitochondrien führen zum Versagen des zellulären Energiestoffwechsels. Oxidativer Stress soll auch dem zentralen Nervensystem schaden und zu Krankheiten wie Schlaganfall, Parkinson oder Alzheimer führen können. Laut EMA Assessment Report (19.02.2021) (Seite 48) betrug der Prozentsatz, der unverändert mit den Fäkalien ausgeschiedenen Dosis ~1 % für ALC-0315 und ~50 % für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien nachgewiesen wurde, „könnte“ der Stoffwechsel laut EMA eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) existieren zum neuartigen, medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Mit Bezug auf die Ausscheidung von ALC-0315 stellt die EMA Vermutungen an. Ob und wie das neuartige, kationische Lipid ALC-0315 vom Organismus ausgeschieden wird ist der EMA nicht bekannt. Diese Tatsache stellt ein unabsehbares Sicherheitsrisiko dar. Warum wird der Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses eklatanten Sicherheitsmangels als sicher bezeichnet?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 49) geht hervor: „The animal model of choice, the rat, has not been assessed in the pharmacological dossier but a limited absorption/distribution study has been conducted in pharmacokinetics dossier. Immunogenicity was assessed in the toxicology studies.“
Aus dem EMA Comirnaty Risk Management Plan (25.11.2021) geht hervor (Seite 35)
COVID-19 mRNA vaccine (V9) was evaluated clinically and submitted for application. Two GLP-compliant repeat-dose toxicity studies were performed in Wistar Han rats; one with each variant. Both studies were 17 days in duration with a 3-week recovery period. A DART study in Wistar Han rats has been completed.
58:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 49) wurde das ausgewählte Tiermodell, die Ratte, im pharmakologischen Dossier „nicht bewertet“, aber eine „begrenzte“ Absorptions-/Verteilungsstudie wurde im pharmakokinetischen Dossier durchgeführt. Ein Dossier zum Prüfpräparat enthält Angaben zu Qualität und Herstellung des Prüfproduktes, den toxikologischen und pharmakologischen Untersuchungen und Daten aus früheren klinischen Prüfungen. Die Absorptions-/Verteilungsstudie war „begrenzt“. Die Studien zur Toxikologie umfassten laut EMA Comirnaty Risk Management Plan (25.11.2021) (Seite 35) nur die Zeitdauer von 17 Tagen + 3 Wochen Erholungsphase. Studien zur chronischen Toxizität wurden nicht durchgeführt. Der aktuelle Status der spezifischen Verpflichtung 2 (SO2) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 6) mit „nicht erfüllt“ vermerkt. Somit wird die Qualität des neuartigen, medizinischen Hilfsstoffs funktionelles, kationisches Lipid ALC-0315, laut Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 24), von der EMA als nicht akzeptabel angesehen. Es wurde nur eine „begrenzte Absorptionsstudie/Verteilungsstudie vorgelegt, die Studien zur Toxikologie umfassten nur die Zeitdauer von 17 Tagen + 3 Wochen Erholungsphase. Aufgrund der Nichterfüllung der spezifischen Verpflichtung 2 (SO2) wird die Qualität des medizinischen Hilfsstoffs ALC-0315 von der EMA als nicht akzeptabel angesehen. Warum wird der Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieser eklatanten Sicherheitsmängel als sicher bezeichnet?
Aus dem EMA Assessment Report (19.02.2021) (Seite 46) geht, hervor: „For ALC-0315 (aminolipid), the maximum detected concentration in the liver (294 μg/g liver) was reached 3 hours after IV injection“. ALC-0315 was eliminated slowly from the liver and after 2-weeks the concentration of ALC-0315 was still ~25 % of the maximum concentration indicating that ALC-0315 would be eliminated from rat liver in approximately 6-weeks.“
und „Following plasma clearance, the liver appears to be to major organ to which ALC-0315 and ALC-0159 distribute. The applicant has estimated the percent of dose distributed to the liver to be ~60 % for ALC-0315 and ~20 % for ALC-0159.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) geht hervor: „While there was no detectable excretion of either lipid in the urine, the percent of dose excreted unchanged in faeces was ~1 % for ALC-0315 and ~50 % for ALC-0159. Since almost no unchanged ALC-3015 was detected in urine or faeces, metabolism may play a bigger role in the elimination of ALC-0315 than ALC-0159.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 53) geht hervor: „ALC-0315 has no known biology. In the absence of this ‘biological relevance’ the applicant used an estimation of > 95 % elimination of ALC-0315 to represent the essential elimination from the body. The elimination half-life of ALC-0315 in the liver following IV administration in the rat is approximately 6-8 days. These data indicate that 95 % elimination of ALC-0315 will occur approx. 30-40 days following final administration in the rat.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor (Seite 134): This vaccine contains two new components (cationic lipid ALC-0315 and PEGylated liquid ALC-0159) in the LNP, for which there is limited experience. Some uncertainties remain regarding the ALC-0315 long half-life.
59:
Die EMA führt im EMA Assessment Report Comirnaty (19.02.2021) (Seite 45) die Pfizer Studie PF-07302048_06Jul20_072424 an und erklärt (Seite 46), dass die maximale Konzentration an ALC-0315, nach der Verabreichung von Pfizer/BioNTech Comirnaty, in der Leber der Versuchstiere, nach 3 Stunden festgestellt wurde. Die Pfizer Studie PF-07302048_06Jul20_072424 kann mittlerweile von der Öffentlichkeit eingesehen werden. Wie Bloomberg Law berichtete, wollte die US-Food and Drug Administration (FDA), die Öffentlichkeit bis zum Jahr 2096 warten lassen, um alle Daten offenzulegen, auf die sie sich bei der Lizenzierung des Pfizer Covid-19 Impfstoffs stützte. Aufgrund einer richterlichen Anordnung von US-Bezirksrichter Mark T. Pittman, Northern District of Texas muss die FDA nun pro Monat mehr als 55.000 Seiten, im Zusammenhang mit der Lizenzierung des Pfizer-BioNTech Covid-19-Impfstoffs, veröffentlichen. Diese Daten sind nun auf der Website der Organisation Public Health and Medical Professionals for Transparency für die Öffentlichkeit verfügbar.
Im Pfizer Dokument: PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary 1, das nun, auf der Website von Public Health and Medical Professionals for Transparency verfügbar ist, wird unter Absatz BNT162b2 2.6.5.5B. Pharmacokinetics: organ distribution continued (Seite 7) eine tabellarische Auflistung der durchschnittlichen Gesamtlipidkonzentration der medizinischen Hilfsstoffe ALC-0315 und ALC-0159, nach der Verabreichung von 1 Dosis - 50 µg BNT162b2 Comirnaty an Wistar Han Ratten, für den Beobachtungszeitraum von 48 Stunden angegeben. Die durchschnittliche Lipid-Gesamtkonzentration (µg Lipidäquivalent/g (oder mL) (männlich und weiblich zusammen) hatte in der Leber der Versuchstiere während des gesamten Beobachtungszeitraums von 48 Stunden nach 8 Stunden die maximale Konzentration in erreicht, war danach, nach 24 Stunden, abgefallen und nach 48 Stunden erneut angestiegen. Aus dem EMA Assessment Report (19.02.2021) (Seite 46) geht, jedoch hervor: „Bei ALC-0315 (Aminolipid) wurde die maximale Konzentration in der Leber (294 μg/g Leber) 3 Stunden nach der intravenösen Injektion erreicht.“ Diese Angabe im EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) zur maximalen Konzentration an ALC-0315 in der Leber der Versuchstiere - Wistar Han Ratten passt nicht zu den Angaben zu den durchschnittlichen Gesamtkonzentrationswerten der medizinischen Hilfsstoffe ALC-0315 und ALC-0159 im Pfizer Dokument: PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary 1 (Seite 7). Die Verteilung der prozentualen Dosis in der Leber wurde laut Schätzung des Antragstellers im EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) mit 60 % für ALC-0315 und 20 % für ALC-0159 angegeben. Es ist daher der medizinische Hilfsstoff ALC-0315, der sich zu einem großen Anteil in die verschiedenen Organe, das Knochenmark, die Drüsen usw. im Organismus verteilt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen mit Bezug auf den neuartigen, medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungswerte vor und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Während laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) von beiden Lipiden keine Ausscheidung im Urin nachweisbar war, betrug der prozentuale Anteil, der unverändert mit den Fäzes ausgeschiedenen Dosis ~1 % für ALC-0315 und ~50 % für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäzes nachgewiesen wurde, „könnte“ der Stoffwechsel eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Das heißt, der EMA ist nicht bekannt, ob ALC-0315 überhaupt vollständig aus dem Organismus eliminiert wird. Wie aus dem der Pfizer Studie BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary 2 (Seite 5) unter Table 2.6.4-1. PK of ALC-0315 and ALC-0159 in Wistar Han Rats After IV Administration of LNPs Containing Surrogate Luciferase RNA at 1 mg/kg hervorgeht, war der Wert für die Konzentration an ALC-0315 in der Leber der Versuchstiere nach 300 Stunden und darüber noch immer fast derselbe wie nach 200 Stunden. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) wurde ALC-0315 langsam aus der Leber eliminiert, und nach 2 Wochen betrug die Konzentration von ALC-0315, laut EMA, noch ~25 % der maximalen Konzentration, was darauf hindeutet, dass ALC-0315 in etwa 6 Wochen aus der Rattenleber eliminiert sein „würde“.
2.6.5.5B. Pharmakokinetik: Organverteilung Fortsetzung. Testartikel: [ 3H]-markierte LNP-mRNA-Formulierung mit ALC-0315 und ALC-0159 Berichtsnummer: 185350 - Anzahl der Dosen: 1 (Seite 7)
Probe Mittlere Gesamtlipidkonzentration (µg Lipidäquivalent/g (oder mL) (männlich und weiblich zusammen)
|
|
0,25 min |
1h |
2h |
4h |
8h |
24h |
48h |
|
Leber |
0.737 |
4.63 |
11.0 |
16.5 |
26.5 |
19.2 |
24.3 |
Warum wurden im EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) Daten zur durchschnittlichen Gesamtlipidkonzentration an ALC-0315 und ALC-0159 in der Leber der Versuchstiere veröffentlicht, die nicht mit den Angaben zur durchschnittlichen Gesamtlipidkonzentration in der Pfizer Studie PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary 1 (Seite 7) übereinstimmen, wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
59 a.:
Welche Risikobewertungen, Studien, Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. geben Auskunft, innerhalb welcher genauen Zeitspanne, nach der Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty, der neuartige, medizinische Hilfsstoff ALC-0315, vollständig aus der Leber eliminiert wird?
59 b.:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen mit Bezug auf den neuartigen, medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungswerte vor und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Während laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) von beiden Lipiden keine Ausscheidung im Urin der Versuchstiere nachweisbar war, betrug der prozentuale Anteil, der unverändert mit den Fäzes ausgeschiedenen Dosis ~1 % für ALC-0315 und ~50 % für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäzes nachgewiesen wurde, „könnte“ der Stoffwechsel eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Das heißt, der EMA ist nicht bekannt, ob ALC-0315 überhaupt vollständig aus dem Organismus eliminiert wird. Wird der neuartige, medizinische Hilfsstoff ALC-0315 überhaupt vollständig aus der Leber eliminiert?
59 c.:
Im EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) stimmen Daten, die zur durchschnittlichen Gesamtlipidkonzentration an ALC-0315 und ALC-0159, in der Leber der Versuchstiere veröffentlicht wurden, nicht mit den Angaben zur durchschnittlichen Gesamtlipidkonzentration in der Pfizer Studie PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary 1 (Seite 7) überein. Nachdem die durchschnittliche Gesamtlipidkonzentration an ALC-0315 und ALC-0159 nach 24 Stunden in der Leber der Versuchstiere abgesunken war, wurde nach 48 Stunden, erneut ein hoher Wert zur durchschnittlichen Gesamtlipidkonzentration an ALC-0315 und ALC-0159 in der Leber der Versuchstiere gemessen. Laut Angaben der EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) erfolgt die Verteilung der prozentualen Dosis in die Leber mit 60 % für ALC-0315 und 20 % für ALC-0159. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) existieren zum neuartigen, medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315, warum wird der Pfizer/BioNTech COVID-19 Impfstoff trotz dieses Sachverhalts als sicher bezeichnet?
59 d.:
Laut Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary2 (Seite 5) war der Konzentrationswert an ALC-0315 in der Leber der Versuchstiere nach über 300 Stunden beinahe ident mit dem Konzentrationswert nach 200 Stunden. Welche Studien, Risikobewertungen und Dokumente mit Bezug auf Konzentrationswerte an ALC-0315, in der Leber der Versuchstiere, nach z.B. 2000, 4000 Stunden liegen von den Impfstoffherstellern BioNTech - Pfizer Inc. vor?
59 e.:
Laut Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary2 (Seite 5) war der Konzentrationswert an ALC-0315 in der Leber der Versuchstiere nach über 300 Stunden beinahe ident mit dem Konzentrationswert nach 200 Stunden. Nach über 300 Stunden oder 12,5 Tagen war die Konzentration an ALC-0315 in der Leber der Versuchstiere kaum abgesunken. Eine Elimination von ALC-0315 aus der Leber der Versuchstiere hatte in der Zeitspanne von 12,5 Tagen kaum stattgefunden. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) wird jedoch für den Zeitverlauf von 2 Wochen für ALC-0315, nur noch ein Prozentsatz von ~25 % der maximalen Konzentration angegeben, was, laut EMA, darauf „hindeutet“, dass ALC-0315 in etwa 6 Wochen aus der Rattenleber eliminiert sein „würde“. Die Angaben zur Konzentration an ALC-0315 in der Leber der Versuchstiere im EMA Assessment Report Comirnaty (19.02.2021) passen nicht zu den Angaben im Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary2. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
59 f.:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 53) hat ALC-0315 hat keine bekannte Biologie. In Ermangelung dieser "biologischen Relevanz" hatte der Antragsteller eine „Schätzung“ von > 95 % Ausscheidung von ALC-0315 verwendet, um die wesentliche Ausscheidung aus dem Körper darzustellen. Die Eliminationshalbwertszeit von ALC-0315 in der Leber nach intravenöser Verabreichung an die Ratte beträgt, laut EMA, etwa 6-8 Tage. Diese Angaben zur Eliminationshalbwertszeit von ALC-0315 in der Leber der Versuchstiere im EMA Assessment Report Comirnaty (19.02.2021) passen nicht zu den Angaben zur Konzentration an ALC-0315 im Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary2. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
60:
Laut Pfizer Dokument: PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary1 (Seite 7) wurde im Herz der Versuchstiere - Wistar Han Ratten während des gesamten Beobachtungszeitraums von 48 Stunden nach 2 Stunden die maximale durchschnittliche Gesamtlipidkonzentration erreicht, war danach, nach 4, 8 und 24 Stunden abgefallen und nach 48 Stunden erneut angestiegen. Im Herz der Versuchstiere wurden, im Vergleich zu anderen Organen, relativ geringe Werte zur durchschnittlichen Gesamtlipidkonzentration an ALC-0315 und ALC-0159 festgestellt, trotz der relativ geringen Konzentrationswerte an ALC-0315 im Herzen der Versuchstiere wird über Fälle von Myokarditis und Perikarditis, im Zusammenhang mit der Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty, an Menschen, berichtet. Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315, die Sekretion von proinflammatorischen Zytokinen und reaktiven Sauerstoffspezies stimulieren, dies verursacht Entzündungen im Organismus. Mit Bezug auf den neuartigen, medizinischen Hilfsstoff ALC-0315 könnte das Aufkommen von Myokarditis, Perikarditis und anderer Entzündungen, nach der Verabreichung von Pfizer/BioNTech Comirnaty, daher von entscheidender Bedeutung sein. Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) geht hervor, dass nach der Plasma-Clearance die Leber das Hauptorgan zu sein scheint, in dem sich ALC-0315 und ALC-0159 verteilen. Der Antragsteller schätzt den prozentualen Anteil der in der Leber verteilten Dosis auf ~60 % für ALC-0315 und ~20% für ALC-0159. Es ist anzunehmen, dass sich die Verteilung von ALC-0315 und ALC-0159 in das Herz mit einer ähnlichen prozentualen Verteilung, wie in die Leber erfolgt. Während laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) von beiden Lipiden keine Ausscheidung im Urin nachweisbar war, betrug der prozentuale Anteil der unverändert mit den Fäzes ausgeschiedenen Dosis ~1 % für ALC-0315 und ~50 % für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäzes nachgewiesen wurde, „könnte“ der Stoffwechsel eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Der Pfizer/BioNTech COVID-19 Impfstoff Comirnaty enthält laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) zwei neue Komponenten (kationisches Lipid ALC-0315 und PEGyliertes flüssiges ALC-0159) im LNP, für die es nur begrenzte Erfahrungen gibt. Hinsichtlich der langen Halbwertszeit von ALC-0315 existieren einige Unsicherheiten und es ist nicht genau geklärt wie ALC-0315 über den Stoffwechsel abgebaut und ausgeschieden wird.
2.6.5.5B. Pharmakokinetik: Organverteilung Fortsetzung. Testartikel: [ 3H]-markierte LNP-mRNA-Formulierung mit ALC-0315 und ALC-0159 Berichtsnummer: 185350 - Anzahl der Dosen: 1
Probe Mittlere Gesamtlipidkonzentration (µg Lipidäquivalent/g (oder mL) (männlich und weiblich zusammen)
|
|
0.25 min |
1h |
2h |
4h |
8h |
24h |
48h |
|
Herz |
0.282 |
1.03 |
1.40 |
0.987 |
0.790 |
0.451 |
0.546 |
Laut Pfizer Dokument: PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary 1 (Seite 7) wurde im Herz der Versuchstiere - Wistar Han Ratten während des gesamten Beobachtungszeitraums von 48 Stunden nach 2 Stunden die maximale Gesamtlipidkonzentration erreicht, war danach, nach 4, 8 und 24 Stunden abgefallen und nach 48 Stunden erneut angestiegen. Laut Angaben der EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) erfolgte die Verteilung der prozentualen Dosis in die Leber mit 60 % für ALC-0315 und 20 % für ALC-0159. Es ist daher anzunehmen, dass auch in das Organ Herz eine ähnliche Verteilung der prozentualen Dosis an ALC-0315 und ALC-0159 erfolgt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen mit Bezug auf den neuartigen, medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungswerte vor und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Während laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) von beiden Lipiden keine Ausscheidung im Urin nachweisbar war, betrug der prozentuale Anteil, der unverändert mit den Fäzes ausgeschiedenen Dosis ~1 % für ALC-0315 und ~50 % für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäzes nachgewiesen wurde, „könnte“ der Stoffwechsel eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Das heißt, der EMA ist nicht bekannt, ob ALC-0315 überhaupt vollständig aus dem Organismus eliminiert wird. Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315, die Sekretion von proinflammatorischen Zytokinen und reaktiven Sauerstoffspezies stimulieren, dies verursacht Entzündungen im Organismus. Haben die Impfstoffhersteller BioNTech - Pfizer Inc. im Rahmen von Studien zur Toxikologie untersucht, ob das Aufkommen von Myokarditis oder Perikarditis, nach der Verabreichung von Pfizer/BioNTech Comirnaty, im Zusammenhang mit der proinflammatorischen Wirkung des kationischen Lipids ALC-0315 steht?
60 a.:
Welche Studien, Dokumente und Risikobewertungen der Impfstoffhersteller BioNTech - Pfizer Inc. dokumentieren, innerhalb welcher genauen Zeitspanne ALC-0315 vollständig aus dem Organ Herz eliminiert wird?
60 b.:
Wird der neuartige, medizinische Hilfsstoff ALC-0315 überhaupt vollständig aus dem Organ Herz eliminiert?
60 c.:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum neuartigen, medizinischen Hilfsstoff nur begrenzte Erfahrungen vor und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Wird ALC-0315 nicht vollständig aus dem Organ Herz eliminiert, könnte ALC-0315, nach der Verabreichung von Pfizer/BioNTech Comirnaty, durch die Sekretion von proinflammatorischen Zytokinen und reaktiven Sauerstoffspezies permanent Herzmuskelentzündungen und Herzbeutelentzündungen verursachen. Wie lautet die Stellungnahme zu diesem Sachverhalt mit Bezug auf die Sicherheit des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty?
60 d.:
Laut Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary2 (Seite5) war der Konzentrationswert an ALC-0315 in der Leber der Versuchstiere nach über 300 Stunden beinahe ident mit dem Konzentrationswert nach 200 Stunden. Wurde der Konzentrationswert an ALC-0315 im Herz der Versuchstiere nach 300 Stunden, im Rahmen von Studien zur Toxikologie, überhaupt von den Impfstoffherstellern BioNTech - Pfizer Inc. untersucht?
60 e.:
Welche Studien, Risikobewertungen und Dokumente mit Bezug auf Konzentrationswerte an ALC-0315, im Herz der Versuchstiere, nach z.B. 2000, 4000 Stunden liegen von den Impfstoffherstellern BioNTech - Pfizer Inc. vor?
61:
Laut Pfizer Dokument: PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary1 (Seiten 7 u. 8) wurde in den Nebennieren, Knochen (Oberschenkel), Knochenmark (Oberschenkel), Augen, Lymphknoten (Unterkiefer), Lymphknoten (Bauchfell), Eierstöcken, Milz, Hoden, Uterus der Versuchstiere - Wistar Han Ratten während des gesamten, von Pfizer/BioNTech angegebenen Beobachtungszeitraums, von 48 Stunden, die höchste durchschnittliche Gesamtlipidkonzentration an ALC-0315 und ALC-0159 nach 48 Stunden erreicht. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) schätzte Antragsteller den prozentualen Anteil der in der Leber verteilten Dosis auf ~60 % für ALC-0315 und ~20 % für ALC-0159. Es ist anzunehmen, dass die Verteilung an ALC-0315 und ALC-0159 auch auf andere Bereiche des Organismus zutrifft.
Im EMA Assessment Report Comirnaty (19.02.2021) (Seite 47) wurden folgende Angaben zur Zeitdauer der Studie, über die Messung der Gesamtlipidkonzentration an ALC-0315 und ALC-0159 gemacht: „Im Laufe von 48 Stunden wurde die Verteilung hauptsächlich in Leber, Nebennieren, Milz und Eierstöcken beobachtet, wobei die höchsten Konzentrationen 8-48 Stunden nach der Verabreichung auftraten. Die Gesamtwiederfindung (in % der injizierten Dosis) der radioaktiv markierten LNP+modRNA außerhalb der Injektionsstelle war in der Leber am größten (bis zu 21,5 %) und lag in Milz (≤1,1 %), Nebennieren (≤0,1 %) und Eierstöcken (≤0,1 %) deutlich niedriger.“
Die EMA erwähnt am Anfang einen Beobachtungszeitraum von 48 Stunden, in dem die Verteilung von vor allem ALC-0315, ALC-0159 und der mRNA in der in Leber, den Nebennieren, der Milz und den Eierstöcken usw. untersucht wurde. Laut EMA traten die höchsten Konzentrationen 8-48 Stunden nach der Verabreichung auf, diese Aussage der EMA bezieht sich jedoch auf den Beobachtungszeitraum von 48 Stunden, wie er im Dokument Pfizer Dokument: PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary 1 (Seiten 7 u. 8) angegeben wird. Mit den Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 47) wird der Eindruck erweckt, dass die höchsten Konzentrationen an vor allem ALC-0315 und ALC-0159 in Leber, den Nebennieren, der Milz und den Eierstöcken usw. nach 48 Stunden beobachtet wurden. Zu einem längeren Beobachtungzeitraum werden von der EMA jedoch keine Angaben gemacht. Laut Angaben Im Pfizer Dokument: BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary2 (Seite5) Figure 2.6.4-1. Plasma and Liver Concentrations of ALC-0315 and ALC-0159 in Wistar Han Rats After IV Administration of LNPs Containing Surrogate Luciferase RNA at 1 mg/kg (Seite 5) wurden jedoch noch nach über 300 Stunden sehr hohe Konzentrationswerte an ALC-0315 in der Leber der Versuchstiere beobachtet. Es ist daher anzunehmen, dass diese hohen Konzentrationswerte an ALC-0315, nach einer Zeitspanne von über 300 Stunden, auch in den Nebennieren, Knochen (Oberschenkel), Knochenmark (Oberschenkel), Augen, Lymphknoten (Unterkiefer), Lymphknoten (Bauchfell), Eierstöcken, Milz, Hoden, Uterus der Versuchstiere beobachtet wurden. Wie aus der wissenschaftlichen Arbeit von Sonia Ndeupen et al. (Dezember 2021) bekannt, wurde der potenziell entzündliche Charakter von Lipidnanopartikeln, die kationische Lipide, wie ALC-0315, enthalten, nicht bewertet. Ob das langfristige Vorhandensein ionisierbarer Lipide zu einem niedrigen Niveau chronischer Entzündungen und einer Erschöpfung des Immunsystems führen könnte, muss noch ermittelt werden. Laut Xucheng Hou et al. (Dezember 2021) wurde berichtet, dass kationische und ionisierbare Lipide, wie ALC-0315, die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies stimulieren. Während laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46 u. 48) von beiden Lipiden keine Ausscheidung im Urin nachweisbar war, betrug der prozentuale Anteil der Dosis, der unverändert mit den Fäkalien ausgeschieden wurde, ~1 % für ALC-0315 und ~50% für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien nachgewiesen wurde, „könnte“ der Stoffwechsel laut EMA eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Das heißt, der EMA ist nicht bekannt, ob ALC-0315 überhaupt vollständig aus dem Organismus eliminiert wird. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben einige Unsicherheiten bezüglich der langen Halbwertszeit von ALC-0315. Es ist daher nicht genau geklärt, wie ALC-0315 über den Stoffwechsel abgebaut und ausgeschieden wird.
2.6.5.5B. Pharmakokinetik: Organverteilung Fortsetzung. Testartikel: [ 3H]-markierte LNP-mRNA-Formulierung mit ALC-0315 und ALC-0159 Berichtsnummer: 185350 - Anzahl der Dosen: 1
Probe Mittlere Gesamtlipidkonzentration (µg Lipidäquivalent/g (oder mL) (männlich und weiblich zusammen)
|
|
0.25 min |
1h |
2h |
4h |
8h |
24h |
48h |
|
Nebennieren |
0.271 |
1.48 |
2.72 |
2.89 |
6.80 |
13.8 |
18.2 |
|
Knochen (Oberschenkel) |
0.091 |
0.195 |
0.266 |
0.276 |
0.340 |
0.342 |
0.687 |
|
Knochenmark (Oberschenkel) |
0.479 |
0.960 |
1.24 |
1.24 |
1.84 |
2.49 |
3.77 |
|
Augen |
0.010 |
0.035 |
0.052 |
0.067 |
0.059 |
0.091 |
0.112 |
|
Herz |
0.282 |
1.03 |
1.40 |
0.987 |
0.790 |
0.451 |
0.546 |
|
Leber |
0.737 |
4.63 |
11.0 |
16.5 |
26.5 |
19.2 |
24.3 |
|
Lymphknoten (Unterkiefer) |
0.064 |
0.189 |
0.290 |
0.408 |
0.534 |
0.554 |
0.727 |
|
Lymphknoten (Bauchfell) |
0.050 |
0.146 |
0.530 |
0.489 |
0.689 |
0.985 |
1.37 |
|
Eierstöcke |
0.104 |
1.34 |
1.64 |
2.34 |
3.09 |
5.24 |
12.3 |
|
Milz |
0.334 |
2.47 |
7.73 |
10.3 |
22.1 |
20.1 |
23.4 |
|
Hoden |
0.031 |
0.042 |
0.079 |
0.129 |
0.146 |
0.304 |
0.320 |
|
Uterus |
0.043 |
0.203 |
0.305 |
0.140 |
0.287 |
0.289 |
0.456 |
Laut Pfizer Dokument: PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary1 (Seiten 7 u. 8) wurde in den Nebennieren, Knochen (Oberschenkel), Knochenmark (Oberschenkel), Augen, Lymphknoten (Unterkiefer), Lymphknoten (Bauchfell), Eierstöcken, Milz, Hoden, Uterus der Versuchstiere - Wistar Han Ratten während des gesamten, von Pfizer/BioNTech angegebenen Beobachtungszeitraums, von 48 Stunden, die höchste durchschnittliche Gesamtlipidkonzentration an ALC-0315 und ALC-0159 nach 48 Stunden erreicht. Wurde die durchschnittliche Gesamtlipidkonzentration an ALC-0315 und ALC-0159 von den Impfstoffherstellern BioNTech - Pfizer Inc. auch über eine längeren Beobachtungszeitraum als 48 Stunden untersucht?
61 a.:
Laut Xucheng Hou et al. (Dezember 2021) stimulieren kationische, wie ALC-0315, die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) existieren laut EMA einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Während laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) von beiden Lipiden keine Ausscheidung im Urin nachweisbar war, betrug der prozentuale Anteil der unverändert mit den Fäzes ausgeschiedenen Dosis ~1% für ALC-0315 und ~50% für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäzes nachgewiesen wurde, „könnte“ der Stoffwechsel eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Das heißt, der EMA ist nicht bekannt, ob ALC-0315 überhaupt vollständig aus dem Organismus eliminiert wird. Sollte ALC-0315 nicht aus dem Organismus eliminiert werden, kann die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies, die durch ALC-0315 stimuliert wird, zu einer Vielzahl an Krebserkrankungen z.B. in den Nebennieren, Knochen, Knochenmark, den Lymphknoten, den Eierstöcken, der Milz, den Hoden, im Uterus etc. führen. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
61 b.:
Laut Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary2 (Seite5) war der Konzentrationswert an ALC-0315 in der Leber der Versuchstiere nach über 300 Stunden beinahe ident mit dem Konzentrationswert nach 200 Stunden. Welche Studien, Risikobewertungen und Dokumente zu den Konzentrationswerten an ALC-0315, nach z.B. 2000, 4000 Stunden etc. in den Nebennieren, Knochen (Oberschenkel), Knochenmark (Oberschenkel), Augen, Lymphknoten (Unterkiefer), Lymphknoten (Bauchfell), Eierstöcken, Milz, Hoden, Uterus der Versuchstiere liegen von den Impfstoffherstellern BioNTech - Pfizer Inc. vor?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) geht hervor: „While there was no detectable excretion of either lipid in the urine, the percent of dose excreted unchanged in faeces was ~1% for ALC-0315 and ~50% for ALC-0159.“ und (Seite 48) „While there was no detectable excretion of either lipid in the urine, the percent of dose excreted unchanged in faeces was ~1% for ALC-0315 and ~50% for ALC-0159. Since almost no unchanged ALC-3015 was detected in urine or faeces, metabolism may play a bigger role in the elimination of ALC-0315 than ALC-0159.“ und (Seite134) „This vaccine contains two new components (cationic lipid ALC-0315 and PEGylated liquid ALC-0159) in the LNP, for which there is limited experience. Some uncertainties remain regarding the ALC-0315 long half-life.“
62:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) war von den Lipiden ALC-0315 und ALC-0159 keine Ausscheidung im Urin der Versuchstiere nachweisbar. Der Prozentsatz der unverändert mit den Fäzes ausgeschiedenen Dosis betrug ~1 % für ALC-0315 und ~50 % für ALC-0159. (Seite 48) Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien der Versuchstiere nachgewiesen wurde, spielt der Stoffwechsel möglicherweise eine größere Rolle bei der Ausscheidung von ALC-0315 eine größere Rolle spielen als bei ALC-0159. Welche genaue Rolle spielt der Stoffwechsel bei der Ausscheidung von ALC-0315? Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor?
62 a.:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Wird ALC-0315 über den Stoffwechsel überhaupt völlig ausgeschieden? Verbleibt ein Teil an ALC-0315 für unbestimmte Zeit im Organismus? Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech Pfizer Inc. liegen vor?
Welche Studien, Risikobewertungen und Dokumente zur exakten Halbwertszeit und zu den exakten Eliminationszeiten von ALC-0315 liegen von den Impfstoffherstellern BioNTech - Pfizer Inc. vor? (Bitte um Übermittlung der Unterlagen)
Pfizer Dokument: PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary (Seiten 7 u. 8)
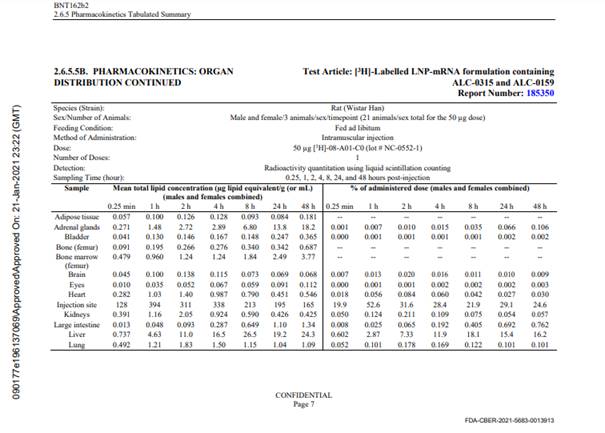
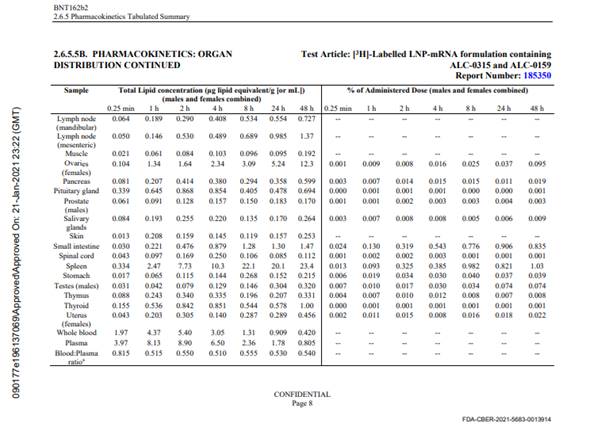
Quelle: https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M2_26_pharmkin-tabulated-summary.pdf
BNT162b2
Module 2.6.4. Pharmacokinetics Written Summary (Seite5)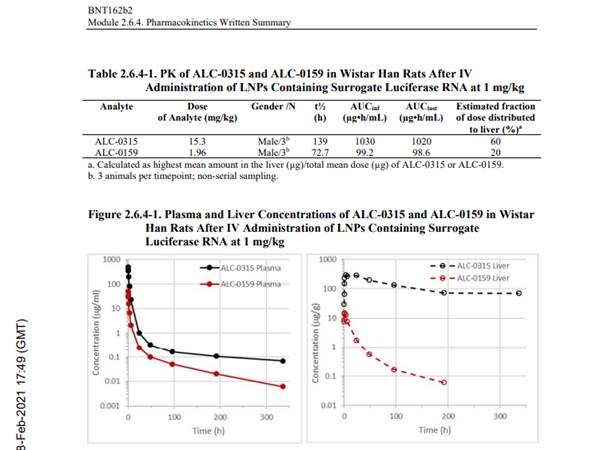
Quelle: https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M2_26_pharmkin-written-summary.pdf
Die Antwort des Bundesministeriums zur Sicherheit des medizinischen Hilfsstoffs ALC-0315 im Pfizer/BioNTech COVID-19 mRNA-Impfstoff - Schreiben: 9101/AB vom 14.03.2022 zu 9250/J (XXVII. GP) lautete wie folgt Antwort Frage 17: „….Weiters wird durch die sehr limitierte Verabreichung von Comirnaty und sehr geringe ALC-0315 Konzentration in Comirnaty der „less-than lifetime toxicological threshold of concern“ (wie in der Guideline ICH M7(R2) definiert) von ALC-0315 bei weitem nicht überschritten. Da dieser international definierte Grenzwert nicht überschritten wird, kann abschließend zusammengefasst werden, dass es sich bei ALC-0315 in der vorliegenden Konzentration in Comirnaty um einen unbedenklichen medizinischen Hilfsstoff handelt.“[29]
Aus dem Pfizer Sicherheitsdatenblatt Pfizer-BioNTech COVID-19 Vaccine Datenstand 07.12.2021 (Seiten 1 u. 2) geht hervor: „2.1. Einstufung des Stoffs oder Gemischs: GHS-Klassifizierung: Nicht als gefährlich klassifiziert, Hinweis: Dieses Dokument wurde in Übereinstimmung mit den Standards für Arbeitsplatzsicherheit erarbeitet, nach denen alle bekannten Gefahren des Produktes oder seiner Inhaltsstoffe ungeachtet des potentiellen Risikos genannt werden müssen. Die angegebenen Vorsichts- und Warnhinweise treffen möglicherweise nicht in jedem Falle zu. In Abhängigkeit von der potentiellen Exposition an ihrem Arbeitsplatz weichen Ihre Anforderungen möglicherweise von den Angaben ab.“[30]
Die medizinischen Hilfsstoffe ALC-0315 2036272-55-4 und ALC-0159 1849616-42-7 werden im Pfizer Sicherheitsdatenblatt Pfizer-BioNTech COVID-19 Vaccine Datenstand 07.12.2021 unter Abschnitt 3: Zusammensetzung/Angaben zu Bestandteilen, von Pfizer, als ungefährliche Substanzen eingestuft und ein spezifischer Konzentrationsgrenzwert (SCL) wird daher nicht angegeben.
Aus dem Dokument Länderausschuss für Arbeitsschutz und Sicherheitstechnik Leitlinien zur Gefahrstoffverordnung (Seite 31) geht hervor: „D 1.3 § 6 Abs. 2 Satz 3 Welche Fallkonstellationen sind hier gemeint: Die Verpflichtungen zu Lieferung/Bereitstellung von Sicherheitsdatenblättern (SDB) sind in Artikel 31 der REACH-VO geregelt. Ergänzend beinhaltet Artikel 32 der REACH-VO Informationspflichten des Lieferanten zu Stoffen/ Zubereitungen, für die kein SDB nach Art. 31 geliefert werden muss. Hierauf nimmt § 6 Abs. 2 Satz 2 Bezug. Diese Informationspflichten gelten gemäß Artikel 2 Abs. 1 und 6 REACH-VO jedoch nicht für alle Gefahrstoffe, z.B. nicht für fertige Arzneimittel. Um für die Arbeitgeber das erforderliche, umfassende Informationsrecht sicherzustellen, wurde der Lieferant in § 6 Abs. 2 Satz 3 GefStoffV verpflichtet, die für die Gefährdungsbeurteilung notwendigen Informationen über die Gefahrstoffe zur Verfügung zu stellen. Der Arbeitgeber ist verpflichtet, diese Informationen einzuholen.“
Aus dem WKO Leitfaden: Das GHS-System in der Praxis geht hervor (Seite7): „Werden gefährliche Eigenschaften festgestellt, wird der Stoff oder das Gemisch entsprechend eingestuft. Die Hersteller, Importeure, nachgeschalteten Anwender (Formulierer) und Händler von Stoffen und Gemischen haben die Verpflichtung, die identifizierten Gefahren den Akteuren in der Lieferkette sowie den Konsumenten mitzuteilen.“ und (Seite 27) „Weisen geeignete und zuverlässige wissenschaftliche Daten für einen Stoff eine bestimmte Gefahr (z. B. ätzend, reizend, sensibilisierend, STOT, CMR) eindeutig nach, wird nach Bedarf zusammen mit der Einstufung auch ein sogenannter spezifischer Konzentrationsgrenzwert (SCL11) in Gemischen oder als Verunreinigung festgelegt. Ein SCL ist stoffspezifisch und notwendig, wenn der gefahrbestimmende Stoff in einer Konzentration vorhanden ist, die ■ unter den für die einzelnen Gefahrenklassen in Anhang I Teil 2 festgelegten Konzentrationen oder ■ unter den für die einzelnen Gefahrenklassen in Anhang I Teile 3, 4 und 5 festgelegten allgemeinen Konzentrationsgrenzwerten liegt.“[31]
Im Sicherheitsdatenblatt des Herstellers Cayman Chemical Datenstand 22.09.2021 war zum Produkt ALC-0315, das auch im Pfizer/BioNTech COVID-19 Impfstoff verwendet wird, vermerkt: (Seiten 1 u. 2) „Classification of the substance or mixture, GHS08 Health hazard, Carc. 1A H350 May cause cancer.“
Aus dem EMA Assessment Report Comirnaty 19.02.2021 (Seite 50) geht hervor: „Genotoxicity: No genotoxicity studies have been provided. This is acceptable as the components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 55) „No genotoxicity nor carcinogenicity studies have been provided. The components of the vaccine formulation are lipids and RNA that are not expected to have genotoxic potential.“ (Seite 56) „As per guidance, no genotoxicity nor carcinogenicity studies were performed. The components of the vaccine (lipids and mRNA) are not expected to have genotoxic potential. This is acceptable to the CHMP.“
Aus dem EMA Assessment Report Comirnaty 19.02.2021 (Seite 134) geht hervor: „This vaccine contains two new components (cationic lipid ALC-0315 and PEGylated liquid ALC-0159) in the LNP, for which there is limited experience. Some uncertainties remain regarding the ALC-0315 long half-life.“
Frage 63: Mit Bezug auf die Überprüfung zur Genotoxizität hinsichtlich der neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 gibt die EMA im EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) an, dass keine Studien zur Genotoxizität durchgeführt wurden. Dies war für die EMA „akzeptabel“, da es sich bei den Bestandteilen der Impfstoffformulierung um Lipide (kationisches Lipid ALC-0315 und PEGyliertes Lipid ALC-0159) und RNA handelt, bei denen kein genotoxisches Potenzial zu „erwarten“ ist (Seite 56) - „Gemäß den Leitlinien wurden weder Genotoxizitäts- noch Karzinogenitätsstudien durchgeführt. Es wird nicht erwartet, dass die Bestandteile des Impfstoffs (Lipide und mRNA) ein genotoxisches Potenzial haben. Dies ist für den CHMP akzeptabel." Obwohl die WHO in der Leitlinie WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 unter Absatz 4.2.3 zu bedenken gibt, dass im Fall neuartiger, medizinischer Hilfsstoffe Studien zur Genotoxizität erforderlich sein können. Laut EMA Assessment Report Comirnaty 19.02.2021 (Seite 134) liegen zu den neuartigen medizinischen Hilfsstoffen ALC-0315 und ALC-0159 nur begrenzte Erfahrungen vor und es verbleiben Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Im Sicherheitsdatenblatt des Herstellers Cayman Chemical - Datenstand 22.09.2021 war zum Produkt ALC-0315, das auch im Pfizer/BioNTech COVID-19 Impfstoff, laut Angaben Bundesministerium, in modifizierter/optimierter Form verwendet wird, vermerkt (Seiten 1 u. 2): "Einstufung des Stoffes oder Gemisches, GHS08 Gesundheitsgefahr, Carc. 1A H350 Kann Krebs verursachen."
Wie wurde trotz fehlender Studien zur Genotoxizität und Karzinogenität, mit Bezug auf das kationische Lipid ALC-0315, im Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty, laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) der less-than lifetime toxicological threshold of concern oder spezifische Konzentrationsgrenzwert (SCL) für den neuartigen, medizinischen Hilfsstoff ALC-0315 ermittelt?
63 a.:
Aus dem Pfizer Sicherheitsdatenblatt Pfizer-BioNTech COVID-19 Vaccine Datenstand 07.12.2021[32] (Seiten 1 u. 2) geht hervor: „2.1. Einstufung des Stoffs oder Gemischs: GHS-Klassifizierung: Nicht als gefährlich klassifiziert, Hinweis: Dieses Dokument wurde in Übereinstimmung mit den Standards für Arbeitsplatzsicherheit erarbeitet, nach denen alle bekannten Gefahren des Produktes oder seiner Inhaltsstoffe ungeachtet des potentiellen Risikos genannt werden müssen. Die angegebenen Vorsichts- und Warnhinweise treffen möglicherweise nicht in jedem Falle zu. In Abhängigkeit von der potentiellen Exposition an ihrem Arbeitsplatz weichen Ihre Anforderungen möglicherweise von den Angaben ab.“ Aus dem WKO Leitfaden[33]: Das GHS-System in der Praxis geht hervor (Seite7): „Werden gefährliche Eigenschaften festgestellt, wird der Stoff oder das Gemisch entsprechend eingestuft. Die Hersteller, Importeure, nachgeschalteten Anwender (Formulierer) und Händler von Stoffen und Gemischen haben die Verpflichtung, die identifizierten Gefahren den Akteuren in der Lieferkette sowie den Konsumenten mitzuteilen.“ Das kationische Lipid ALC-0315 weist gefährliche Eigenschaften auf - Sonia Ndeupen et al. (Dezember 2021), sind diese den Impfstoffherstellern BioNTech - Pfizer Inc. nicht bekannt?
63 b.:
Wie wurde trotz fehlender Studien zur Genotoxizität und Karzinogenität, mit Bezug auf das kationische Lipid ALC-0315, im Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty, laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) der „less-than lifetime toxicological threshold of concern“ oder spezifische Konzentrationsgrenzwert (SCL) für den neuartigen, medizinischen Hilfsstoff ALC-0159 ermittelt?
63 c.:
Die medizinischen Hilfsstoffe ALC-0315 2036272-55-4 und ALC-0159 1849616-42-7 werden im Pfizer Sicherheitsdatenblatt Pfizer-BioNTech COVID-19 Vaccine Datenstand 07.12.2021 unter Abschnitt 3: Zusammensetzung/Angaben zu Bestandteilen, von Pfizer, als ungefährliche Substanzen eingestuft und ein spezifischer Konzentrationsgrenzwert (SCL) wird daher nicht angegeben. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. sind zur Bestimmung des spezifischen Konzentrationsgrenzwerts (SCL) von ALC-0315 verfügbar und bestätigen einwandfrei, dass ALC-0315 als ungefährliche Substanz eingestuft werden kann?
63 d.:
Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. sind zur Bestimmung des spezifischen Konzentrationsgrenzwert (SCL) von ALC-0159 verfügbar und bestätigen einwandfrei, dass ALC-0159 als ungefährliche Substanz eingestuft werden kann?
63 e.:
Im Sicherheitsdatenblatt des Herstellers Cayman Chemical - Datenstand 22.09.2021 war zum Produkt ALC-0315, das auch im Pfizer/BioNTech COVID-19 Impfstoff, laut Angaben Bundesministerium, in modifizierter/optimierter Form verwendet wird, vermerkt (Seiten 1 u. 2): "Einstufung des Stoffes oder Gemisches, GHS08 Gesundheitsgefahr, Carc. 1A H350 Kann Krebs verursachen." Welche Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. geben Aufschluss über den Prozess der Modifizierung und Optimierung des medizinischen Hilfsstoffs ALC-0315, der im Pfizer/BioNTech COVID-19 Impfstoff verwendet wird?
64:
Laut Bundesministerium kann die Angabe von Substanzen in Sicherheitsdatenblättern nicht direkt auf deren Einsatz in Arzneimittel umgelegt werden, da diese Substanzen in der chemischen Industrie zum Beispiel (in welcher Sicherheitsdatenblätter erstellt werden) ein gänzlich anderes Anwendungsspektrum, als in der Arzneimittelherstellung besitzen. In welchem Anwendungsspektrum der chemischen Industrie kommen die medizinischen Hilfsstoffe ALC-0315 und ALC-0159 noch zum Einsatz? Wir ersuchen das Bundesministerium um eine detaillierte Auflistung.
65:
In welchen anderen Medikamenten oder Impfstoffformulierungen mit bedingter oder vollständiger EMA Zulassung werden die pharmazeutischen Hilfsstoffe ALC-0315 und ALC-0159 noch verwendet?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor: (Seite 48) „The two eneral/repeat-dose toxicity studies involved IM exposure of Han Wistar rats to BNT162b2 for a total of 17 days (three weekly administrations) followed by three weeks of recovery.“
Aus dem EMA Comirnaty Risk Management Plan (25.11.2021) geht hervor: (Seite 35) „COVID-19 mRNA vaccine (V9) was evaluated clinically and submitted for application. Two GLP-compliant repeat-dose toxicity studies were performed in Wistar Han rats; one with each variant. Both studies were 17 days in duration with a 3-week recovery period.“
66:
Langzeitstudien mit Versuchstieren wie Nagetieren und Nichtnagetieren zur Prüfung der chronischen Toxizität wurden laut Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) und im EMA Comirnaty Risk Management Plan 25.11.2021 (Seite 35) nicht durchgeführt, denn diese haben laut EMA Dokument: ICH Topic S 4 Duration of Chronic Toxicity Testing in Animals (Rodent and Non Rodent Toxicity Testing) bei Nagetieren eine Zeitdauer von 6 Monaten und bei Nichtnagetieren eine Zeitdauer von 9 Monaten. Die zwei Studien zur Toxizität an Verssuchtieren - Wistar Han Ratten hatten nur eine Zeitdauer von 17 Tagen + 3 Wochen Erholungsphase. Zum medizinischen Hilfsstoff kationisches Lipid ALC-0315 existieren, laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134), nur begrenzte Erfahrungen und es verbleiben einige Unsicherheiten bezüglich der langen Halbwertszeit von ALC-0315. Wie konnte trotz des Verzichts auf Langzeitstudien zur chronischen Toxizität der „less-than lifetime toxicological threshold of concern“ oder der spezifische Konzentrationsgrenzwert (SCL) von ALC-0315 ermittelt werden?
67:
Das synthetische, kationische Lipid ALC-0315 (4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) bildet die Hauptkomponente des Lipidgemischs im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty. Zum synthetischen, kationischen Lipid ALC-0315 (4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) wurden keine Angaben in der Guideline ICH M7(R2) gefunden. Dies ist auch nicht verwunderlich, da im EMA Assessment Report Comirnaty (19.02.2021) erklärt wird, dass zum kationischen Lipid ALC-0315 nur begrenzte Informationen (Seite 23) vorgelegt wurden, dass nur begrenzte Erfahrungen zu ALC-0315 vorliegen (Seite 134) und dass das kationische Lipid ALC-0315 ein neuartiger medizinischer Hilfsstoff ist, der bisher noch nicht in einem in der EU zugelassenen Medizinprodukt verwendet wurde (Seite 28). Dies trifft auch auf das synthetische, PEGylierte Lipid ALC-0159 zu. Auch zum PEGylierten Lipid ALC-0159 (2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide) wurden keine Angaben in der Guideline ICH M7(R2) gefunden. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
67 a.:
In der Guideline ICH M/(R2) wurden keine Angaben zu ALC-0315 (4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) gefunden. Welcher international definierte Grenzwert, mit Bezug auf den medizinischen Hilfsstoff ALC-0315 ist daher in der Guideline ICH M7(R2) vermerkt?
67 b.:
In der Guideline ICH M/(R2) wurden keine Angaben zu ALC-0159 (2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide) gefunden. Welcher international definierte Grenzwert, mit Bezug auf den medizinischen Hilfsstoff ALC-0315 ist daher in der Guideline ICH M7(R2) vermerkt?
68:
Laut Angaben von Wissenschaftlern, Xucheng Hou et al. (Dezember 2021), können kationische Lipide, wie ALC-0315, erhebliche Toxizität durch die Stimulation der Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies im menschlichen Organismus verursachen. Die Verursachung der Toxizität durch das kationische Lipid ALC-0315 erfolgt auf folgendem Weg. Als tertiäres Amin ist ALC-0315 ist durch Protonierung positiv geladen. Diese positive, elektrische Ladung wird, nach der Verabreichung des Impfstoffs, vorerst durch Polyethylenglykol im Lipidnanopartikel inhibiert. Das Zellinnere ist negativ geladen. Nach der Aufnahme des Lipidnanopartikels durch das Vesikel in das innere der Zelle werden Protonen vom Zytosol der Zelle in das Innere des Vesikels gepumpt, damit reichern sich Protonen im Inneren des Vesikel an, damit kommt es zu einer Absenkung des PH-Werts auf ca. 4,7 im Inneren des Vesikels. Dieser saure PH-Wert im Inneren des Vesikels verursacht die Abspaltung des Linkers - N-ditetradecylacetamide im PEG-haltigen Lipid ALC-0159, die positive Ladung des kationischen Lipids ALC-0315 wird somit nicht mehr inhibiert. Die Ladung des Lipidnanopartikel wird dadurch positiv. Das Innere des Vesikels weist nun eine bei weitem höhere positive Ladung auf, als im Inneren der Zelle, das von Natur her eine negative Ladung hat. Durch die positive Ladung im Inneren des Vesikel strömt Wasser aus dem Zytosol in das Vesikel, bis dieses aufplatzt. Die mRNA im Inneren des Nanopartikels wird nun in der Zelle freigesetzt und wird von den Ribosomen abgelesen, die das Spike-Protein produzieren. Durch diesen Vorgang werden aber auch alle anderen Komponenten des Lipidnanopartikels und damit auch das positiv geladene, kationische Lipid ALC-0315 im Inneren der Zelle freigesetzt. Dies ist ein Vorgang, der nicht ohne Verursachung von Toxizität einhergeht. Kationische Lipide, wie ALC-0315, stimulieren laut Xucheng Hou et al. (Dezember 2021) die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies. Dies verursacht Entzündungen und dadurch oxidativen Stress, der zu einer Vielzahl auch lebensbedrohenden und tödlichen Erkrankungen wie z.B. Krebs führt. Während laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) von beiden Lipiden kationisches Lipid ALC-0315 und PEGyliertes Lipid ALC-0159 keine Ausscheidung im Urin nachweisbar war, betrug der Prozentsatz der unverändert mit den Fäzes ausgeschiedenen Dosis ~1 % für ALC-0315 und ~50 % für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäzes nachgewiesen wurde, „könnte“ der Stoffwechsel, laut EMA, bei der Ausscheidung von ALC-0315 möglicherweise eine größere Rolle als bei ALC-0159 spielen. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) enthält der Pfizer/BioNTech COVID-19 Impfstoff Comirnaty zwei neue Komponenten (das kationische Lipid ALC-0315 und die PEGylierte Flüssigkeit ALC-0159) in den Lipidnanopartikeln, für die es nur begrenzte Erfahrungen gibt. Hinsichtlich der langen Halbwertszeit von ALC-0315 verleiben, laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134), einige Unsicherheiten. Wird das kationische Lipid ALC-0315 nicht aus dem Organismus eliminiert, ergibt sich daraus eine enorme gesundheitliche Bedrohung für den Patienten, an den Pfizer/BioNTech Comirnaty verbreicht wurde. Wie lautet die Stellungnahme des Bundesministeriums zur oben angeführten Schilderung der Verursachung von Zytotoxizität, durch das kationische Lipid ALC-0315, mit Bezug auf die Sicherheit des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty?
68 a.:
Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. zur oben angeführten Schilderung der Verursachung von Toxizität durch das kationische Lipid ALC-0315 liegen mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) allgemein vor?
69:
Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315, die Sekretion von entzündungsfördernden Zytokinen stimulieren. Laut Angaben Robert J. Dunlop et al. (2000) spielen Zytokine eine wichtige Rolle bei der Förderung des Wachstums und der Ausbreitung von Krebserkrankungen. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen zu dieser Form der Toxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) vor?
70:
Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide wie ALC-0315 die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies stimulieren. Laut Angaben Michael Schieber et al. (2014) entsteht oxidativer Stress aus einem erhöhten Spiegel an reaktiven Sauerstoffspezies innerhalb der menschlichen Zellen. Laut Angaben Mehdi Sharifi-Rad et al. (2020) spielt oxidativer Stress eine wesentliche Rolle bei der Entstehung chronischer Krankheiten wie Krebs, Herz-Kreislauf-Erkrankungen, Diabetes und neurodegenerativen Erkrankungen. Eine langfristige Exposition gegenüber erhöhten Konzentrationen von pro-oxidativen Faktoren kann strukturelle Defekte auf der Ebene der mitochondrialen DNA sowie funktionelle Veränderungen verschiedener Enzyme und zellulärer Strukturen verursachen, die zu Abweichungen in der Genexpression führen. Oxidativer Stress soll auch dem zentralen Nervensystem schaden und zu Krankheiten wie Schlaganfall, Parkinson oder Alzheimer führen können. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen zur Toxizität des kationischen Lipids ALC-0315, die durch die Stimulation der Sekretion von reaktiven Sauerstoffspezies und den dadurch verursachten oxidativen Stress, mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) von ALC-0315 vor?
71:
Laut Angaben Xucheng Hou et al. (Dezember 2021) ist die Zytotoxizität von Lipidmaterialien ist ein Sicherheitsproblem, das von der Dosis, den Lipideigenschaften und den Zelltypen abhängt. Laut Angaben Xucheng Hou et al. (Dezember 2021) wurde z.B. berichtet, dass die In-vivo-Anwendung von Lipid-Nanopartikeln bei Nagetieren Leber- und Lungenverletzungen hervorruft, was auf die Zytotoxizität der Materialien und die Induktion von entzündungsfördernden Faktoren zurückzuführen sein könnte. Im menschlichen Organismus gibt es mehr als 200 verschiedene Zelltypen, von denen jeder darauf spezialisiert ist, eine bestimmte Funktion zu erfüllen oder ein spezialisiertes Gewebe zu bilden. Die wichtigsten Zelltypen im menschlichen Körper sind: Stammzellen, Rote Blutzellen (Erythrozyten), Weiße Blutzellen (Leukozyten), Blutplättchen (Thrombozyten), Nervenzellen (Neurone), Gliazellen, Muskelzellen (Myozyten), Knorpelzellen (Chondrozyten), Knochenzellen, Hautzellen, Endothelzellen, Epithelzellen, Fettzellen (Adipozyten), Keimzellen (Gameten). Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen hinsichtlich der oben genannten Zelltypen und der Zytotoxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) vor?
72:
Laut Angaben Zhongjie Yu et al. (Mai 2020) bestehen nach wie vor Bedenken hinsichtlich der potenziellen toxikologischen Auswirkungen von Nanopartikeln, da sie eher dazu neigen, übermäßige Mengen an reaktiven Sauerstoffspezies (ROS) zu erzeugen. Aufgrund des starken Oxidationspotenzials können die von Nanopartikeln induzierten überschüssigen ROS zur Schädigung von Biomolekülen und Organellstrukturen führen und eine oxidative Carbonylierung von Proteinen, Lipidperoxidation, DNA/RNA-Bruch und die Zerstörung von Membranstrukturen bewirken, die wiederum Nekrose, Apoptose oder sogar Mutagenese verursachen. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen zu dieser Form der Toxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) vor?
73:
Laut Angaben von R. Tenchov et al. (Juni 2021) können kationische Lipide, wie ALC-0315, die Mitose in Zellen reduzieren. Die Hemmung der Mitose verursacht Polyploidie, die für Kinder im Mutterleib immer tödlich verläuft und zu Fehlgeburten - Totgeburten führt. Wurde diese Form der Toxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder des spezifischen Konzentrationsgrenzwert (SCL) von den Impfstoffherstellern BioNTech - Pfizer Inc. ermittelt?
74:
Laut Angaben von R. Tenchov et al. (Juni 2021) können kationische Lipide, wie ALC-0315, schädliche Auswirkungen auf zelluläre Schlüsselproteine haben, die eine entscheidende Rolle bei nahezu allen zellulären Funktionen haben. Wurde diese Form der Toxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder des spezifischen Konzentrationsgrenzwert (SCL) von den Impfstoffherstellern BioNTech - Pfizer Inc. ermittelt?
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor: (Seite 23) „Two novel excipients are included in the finished product, the cationic lipid ALC-0315 and the PEGylated lipid ALC-0159. Limited information regarding the novel excipients are provided.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor: (Seite 35) „The characterisation and control of active substance and finished product are limited in relation to critical quality attributes and impurities. The suitability of the analytical methods used for control of potency and poly(A) tail have not been fully demonstrated.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor: (Seite 48) „While there was no detectable excretion of either lipid in the urine, the percent of dose excreted unchanged in faeces was ~1% for ALC-0315 and ~50% for ALC-0159. Since almost no unchanged ALC-3015 was detected in urine or faeces, metabolism may play a bigger role in the elimination of ALC-0315 than ALC-0159.“
Aus dem EMA Assessment Report Comirnaty (19.02.2021) geht hervor: (Seite 134): „This vaccine contains two new components (cationic lipid ALC-0315 and PEGylated liquid ALC-0159) in the LNP, for which there is limited experience. Some uncertainties remain regarding the ALC-0315 long half-life.“
75:
Aus der EMA Richtline: Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT geht hervor, dass für Hilfsstoffe, die in keinem Arzneibuch beschrieben sind, Reinheitstests, einschließlich Grenzwerten für Gesamt- und Einzelverunreinigungen durchgeführt werden sollten. Über welche Dokumente verfügen EMA, OMCL`s, Europäisches Direktorat für die Qualität von Arzneimitteln - EDQM zum „less-than lifetime toxicological threshold of concern“ und zum Specific concentration limit (SCL) - spezifischen Konzentrationsgrenzwert, mit Bezug auf den medizinischen Hilfsstoff ALC-0315?
75 a.:
Über welche Dokumente verfügen EMA, OMCL`s, Europäisches Direktorat für die Qualität von Arzneimitteln - EDQM zum „less-than lifetime toxicological threshold of concern“ und zum Specific concentration limit (SCL) - spezifischen Konzentrationsgrenzwert, mit Bezug auf den medizinischen Hilfsstoff ALC-0159?
76:
Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 23) sind zwei neuartige Hilfsstoffe im Fertigarzneimittel, das neuartige, funktionelle kationische Lipid ALC-0315 und das neuartige, funktionelle PEGylierte Lipid ALC-0159 enthalten. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 23) wurden nur begrenzte Informationen mit Bezug die neuartigen, medizinischen Hilfsstoffe funktionelles, kationisches Lipid ALC-0315 und neuartiges, funktionelles, PEGyliertes Lipid ALC-0159 vorgelegt. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 28) sind ALC-0315 und ALC-0159 neuartige Hilfsstoffe, die bisher in keinem in der EU zugelassenen Fertigarzneimittel verwendet wurden. Die Beschreibung und Kontrolle von Wirkstoff und Fertigarzneimittel sind in Bezug auf kritische Qualitätsmerkmale und Verunreinigungen begrenzt, dies betrifft auch die medizinischen Hilfsstoffe funktionelles, kationisches Lipid ALC-0315 und funktionelles, PEGyliertes Lipid ALC-0159. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) war von beiden Lipiden (ALC-0315 und ALC-0159) keine Ausscheidung im Urin der Versuchstiere nachweisbar. Der Prozentsatz der unverändert mit den Fäzes ausgeschiedenen Dosis betrug ~1 % für ALC-0315 und ~50 % für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien nachgewiesen wurde, „könnte“ der Stoffwechsel eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zu den zwei neuartigen Komponenten, funktionelles, kationisches Lipid ALC-0315 und funktionelles, PEGyliertes Lipid ALC-0159, gibt es nur begrenzte Erfahrungen und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315.
Wie konnten der „less-than lifetime toxicological threshold of concern“ oder der spezifische Konzentrationsgrenzwert (SCL) für den neuartigen, medizinischen Hilfsstoff funktionelles kationisches Lipid ALC-0315 aufgrund der mangelhaften Datenlage laut Angaben im EMA Assessment Report Comirnaty (19.02.021) Seiten 23, 28, 48, 134 korrekt ermittelt werden?
76 a.:
Wie konnten der „less-than lifetime toxicological threshold of concern“ oder der spezifische Konzentrationsgrenzwert (SCL) für den neuartigen, medizinischen Hilfsstoff funktionelles Lipid ALC- PEGyliertes Lipid ALC-0159 aufgrund der mangelhaften Datenlage laut Angaben im EMA Assessment Report Comirnaty (19.02.021) Seiten 23, 28, 48, 134 korrekt ermittelt werden?
In diesem Zusammenhang richten die unterfertigten Abgeordneten an den Bundesminister für Soziales, Gesundheit, Pflege und Konsumentenschutz folgende
Anfrage
Frage 1: Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben R. Tenchov et al. (Juni 2021) mit Bezug auf die Reduktion der Mitose durch kationische Lipide, wie ALC-0315, im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty (siehe Nr. 1 in der Begründung)?
Frage 1 a.: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass das kationische Lipid ALC-0315, mit Bezug auf die Zellteilung beim Menschen, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden keinerlei schädigende Wirkung hat? (Bitte um Übermittlung der Unterlagen)
Frage 2: Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben von R. Tenchov et al. (Juni 2021) mit Bezug auf die schädlichen Auswirkungen von kationischen Lipiden, wie ALC-0315, im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, auf zelluläre Schlüsselproteine (siehe Nr. 2 im Text)?
Frage 2 a.: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass das kationische Lipid ALC-0315 mit Bezug auf zelluläre Schlüsselproteine, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen, keinerlei dauerhaft schädigende Wirkung hat? (Bitte um Übermittlung der Unterlagen)
Frage 3: Laut Angaben R. Tenchov et al. (Juni 2021) hängt die Zytotoxizität kationischer Lipide von den Strukturen ihrer hydrophilen Kopfgruppen ab, laut R. Tenchov et al. (Juni 2021) sind Lipidnanopartikel mit quaternären Ammonium-Kopfgruppen toxischer als solche mit tertiären Amin-Kopfgruppen. ALC-0315 ist ein tertiäres Amin und ist daher, laut Tenchov R. et al. (Juni 2021), nur weniger toxisch. Laut Tenchov R. et al. (Juni 2021) ist die Auswirkung der hydrophoben Ketten auf die Toxizität von Lipiden ist nicht gut untersucht, was die Entwicklung weniger toxischer Lipide behindert. Wie lautet die Stellungnahme des Bundesministeriums zu diesen Angaben von R. Tenchov et al. (Juni 2021) mit Bezug auf das kationische Lipid ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 4: Laut Angaben Aleisha R. Brock et al. (Oktober 2021) ist das Risiko für schwangere Personen, nach der Verabreichung eines COVID-19 mRNA Impfstoffs, in den ersten 20 Schwangerschaftswochen einen Spontanabortus zu erleiden, um 7- bis 8-mal höher als die Ergebnisse, die in einem, von den CDC finanzierten, wissenschaftlichen Artikel von Shimabukuro et al. angegeben werden (siehe auch Text oben). Wie lautet die Stellungnahme des Bundesministeriums zu diesen Angaben von Aleisha R. Brock et al. (Oktober 2021) mit Bezug auf den Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 5: Wie lautet die Stellungnahme des Bundesministeriums, zur Bedrohung von ungeborenem Leben durch mRNA-Impfstoffe und kationische Lipide laut Aussagen von R. Tenchov et al. (Juni 2021) und Aleisha R. Brock et al. (Oktober 2021) mit Bezug auf die Empfehlung in der Broschüre des Sozialministeriums, zur Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty an Personen mit Kinderwunsch, Schwangere und Stillende?
Frage 6: Laut Angaben Aleisha R. Brock et al. (Oktober 2021) ist das Risiko von schwangeren Personen, nach der Verabreichung eines COVID-19 mRNA Impfstoffs, in den ersten 20 Schwangerschaftswochen einen Spontanabortus zu erleiden, um 7- bis 8-mal höher, als die Ergebnisse, die in einem, von den CDC finanzierten, wissenschaftlichen Artikel von Shimabukuro et al. angegeben werden. Pfizer/BioNTech gibt jedoch in der Produktinformation Comirnaty an: „Zwar liegen derzeit nur wenige Daten zum Schwangerschaftsausgang nach einer Impfung im ersten Trimenon vor, jedoch wurde kein erhöhtes Risiko für eine Fehlgeburt beobachtet.“ Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 7: Wie lautet die Stellungnahme des Bundesministeriums zu dem Sachverhalt unter Punkt 7 oben im Text?
Frage 8: Wie lautet die Stellungnahme des Bundesministeriums zu diesen Angaben von Xucheng Hou et al. (Dezember 2021) mit Bezug auf das PEGylierte Lipid ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, wie im Punkt 8 im Text oben beschrieben wird?
Frage 8 a.: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass das PEGylierte Lipid ALC-0159, im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, mit Bezug auf Anti-PEG-Antikörper, die durch die Aufnahme von PEG-haltigen Lebensmitteln in der Vergangenheit oder durch eine, in der Vergangenheit bereits verabreichte Dosis an Pfizer/BioNTech Comirnaty COVID-19 Impfstoff, vom Organismus bereits gebildet wurden, nicht zu einer schnellen systemischen Clearance durch eine beschleunigte Blut-Clearance führen und dass das Phänomen der beschleunigten Blutausscheidung, die Bioverfügbarkeit und die Biodistribution, des in PEGylierten Nanopartikeln verkapselten Arzneimittels - Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, dadurch nicht verändert wird und somit keine schweren oder tödlichen Nebenwirkungen, nach der Verabreichung von Pfizer/BioNTech Comirnaty, aufgrund von bereits im Organismus vorhandenen Anti-PEG-Antikörpern, verursacht werden? (Bitte um Übermittlung der Unterlagen)
Frage 9: Laut Angaben Xucheng Hou et al. (Dezember 2021) ist die Zytotoxizität von Lipidmaterialien ein Sicherheitsproblem, das von der Dosis, den Lipideigenschaften und den Zelltypen abhängt. Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben über die Zytotoxizität von Lipidmaterialien, von Xucheng Hou et al. (Dezember 2021), mit Bezug auf das kationische Lipid ALC-0315 im Pfizer/BioNTech Impfstoff Comirnaty?
Frage 9 a.: Die Zytotoxizität von Lipidmaterialien ist, laut Angaben Xucheng Hou et al. (Dezember 2021), ein Sicherheitsproblem, das von der Dosis, den Lipideigenschaften und den Zelltypen abhängt. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die die Zytotoxizität, die durch Lipidmaterialen, wie z.B. ALC-0315, verursacht wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, keine dauerhaft schädigende oder lebensbedrohende Auswirkung auf die verschiedenen Zelltypen des menschlichen Organismus hat? (Bitte um Übermittlung der Unterlagen)
Frage 10: Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben von Xucheng Hou et al. (Dezember 2021) zur Stimulation der Sekretion von entzündungsfördernden Zytokinen, die durch kationische Lipide, wie ALC-0315, verursacht wird und die, laut Robert J. Dunlop et al. (2000), eine wichtige Rolle bei der Förderung, dem Wachstum und der Ausbreitung von Krebserkrankungen spielt, mit Bezug auf das kationische Lipid ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty und zu allen Angaben im Text unter Nr. 10?
Frage 10 a.: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von entzündungsfördernden Zytokinen, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zur Entstehung von Tumoren im Organismus führt (siehe auch Punkt 10a im Text)? (Bitte um Übermittlung der Unterlagen)
Frage 11: Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff, die Sekretion von reaktiven Sauerstoffspezies stimulieren (siehe auch Nr. 11 im Text). Wie lautet die Stellungnahme des Bundesministeriums den Angaben von Xucheng Hou et al. (Dezember 2021) zur Stimulation der Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide verursacht wird, zu den Angaben von Michael Schieber et al. (2014) wonach oxidativer Stress aus einem erhöhten Spiegel an reaktiven Sauerstoffspezies innerhalb der menschlichen Zellen entsteht, der laut Mehdi Sharifi-Rad et al. (2020) eine wesentliche Rolle bei der Entstehung chronischer Krankheiten, wie z.B. Krebs, Herz-Kreislauf-Erkrankungen, Diabetes und neurodegenerativen Erkrankungen spielt, mit Bezug auf das kationische Lipid ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 11a: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten, 50,55, 56) wurden zum neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315 keine Studien zur Genotoxizität oder Karzinogenität durchgeführt (siehe auch Nr. 11a. im Text). Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der die Entstehung von Tumoren im Organismus verursachen kann? (Bitte um Übermittlung der Unterlagen)
Frage 11 b.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der Herz-Kreislauferkrankungen verursachen kann? (Bitte um Übermittlung der Unterlagen)
Frage 11 c.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der Diabetes verursachen kann? (Bitte um Übermittlung der Unterlagen)
Frage 11 d.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der neurodegenerative Erkrankungen verursachen kann? (Bitte um Übermittlung der Unterlagen)
Frage 11 e.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der strukturelle Defekte auf der Ebene der mitochondrialen DNA verursachen kann? (Bitte um Übermittlung der Unterlagen)
Frage 11 f.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen vor und es bestehen noch einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die Sekretion von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, nicht zu oxidativem Stress führt, der funktionelle Veränderungen verschiedener Enzyme und zellulärer Strukturen, die zu Abweichungen in der Genexpression führen, verursachen kann? (Bitte um Übermittlung der Unterlagen)
Frage 12: Laut Angaben Xucheng Hou et al. (Dezember 2021) stimulieren kationische Lipide, wie ALC-0315, die Sekretion von reaktiven Sauerstoffspezies. Laut Angaben Zhongjie Yu et al. (Mai 2020) bestehen nach wie vor Bedenken hinsichtlich der potenziellen toxikologischen Auswirkungen von Nanopartikeln, da sie eher dazu neigen, übermäßige Mengen an reaktiven Sauerstoffspezies (ROS) zu erzeugen. Aufgrund des starken Oxidationspotenzials können die von Nanopartikeln induzierten überschüssigen ROS zur Schädigung von Biomolekülen und Organellstrukturen führen und eine oxidative Carbonylierung von Proteinen, Lipidperoxidation, DNA/RNA-Bruch und die Zerstörung von Membranstrukturen bewirken, die wiederum Nekrose, Apoptose oder sogar Mutagenese verursachen. Wie lautet die Stellungnahme des Bundesministeriums zu den Angaben laut Zhongjie Yu et al. (Mai 2020) mit Bezug das kationische Lipid ALC-0315 im Pfizer/BioNTech Impfstoff Comirnaty?
Frage 12 a.: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die übermäßigen Mengen von reaktiven Sauerstoffspezies ,die durch kationische Lipide, wie ALC-0315, erzeugt werden, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, keinerlei gesundheits- und lebensbedrohende Schädigungen von Biomolekülen und Organellenstrukturen verursachen und keinerlei gesundheits- und lebensbedrohende Schädigungen durch oxidative Carbonylierung von Proteinen, Lipidperoxidation und keine gesundheits- und lebensbedrohenden DNA/RNA-Brüche verursachen, die die Zerstörung von Membranstrukturen bewirken, die sogar Mutagenese verursachen kann (wie oben im Text unter 12 a. ausgeführt)? (Bitte um Übermittlung der Unterlagen)
Frage 13: Wurde von den Impfstoffherstellern BioNTech - Pfizer Inc. untersucht, ob die Symptome Müdigkeit, Abgeschlagenheit, Konzentrationsschwäche und Schlafstörungen im Zusammenhang mit der Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty und dem darin enthaltenen kationischen Lipid ALC-0315 stehen und wurde dies, auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden untersucht (siehe auch oben im Text Nr. 13)?
Frage 14: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor, die einwandfrei bestätigen, dass die übermäßigen Mengen von reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, erzeugt werden, in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty, aber auch mit Bezug auf Langzeitnebenwirkungen - Langzeitschäden, zu keinerlei Art von langfristiger Erhöhung der Thrombozytenzahl führt, die zur Bildung von gesundheits- und lebensbedrohenden Durchblutungsstörungen wie z.B. Blutgerinnseln führen kann (siehe auch Nr. 14 oben im Text)?
Frage 15: Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 1) wurde der potenziell entzündliche Charakter von Lipidnanopartikeln, die kationische Lipide, wie ALC-0315, enthalten nicht bewertet, wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
Frage 16: Bisher wurden, laut Angaben Sonia Ndeupen et al. (Dezember 2021), keine Studien durchgeführt, um die unmittelbaren Entzündungsreaktionen zu beschreiben, die durch diese Impfstoffplattform ausgelöst werden und die möglicherweise die lokalen und systemischen Nebenwirkungen verursachen könnten, wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021) (siehe auch oben im Text)?
Frage 17: Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 2) könnte das von den Lipidnanopartikeln, wie ALC-0315, induzierte Entzündungsmilieu teilweise für die gemeldeten Nebenwirkungen von mRNA-LNP-basierten SARS-CoV-2-Impfstoffen beim Menschen verantwortlich sein und möglicherweise zu ihrer gemeldeten hohen Wirksamkeit bei der Auslösung von Antikörperreaktionen beitragen, wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
Frage 18: Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 6) wurde festgestellt, dass die proprietäre ionisierbare Lipidkomponente, wie ALC-0315, von Lipidnanopartikeln entzündlich ist, wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al (Dezember 2021)?
Frage 19: Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 7) sind weitere Studien erforderlich, um die genaue Art, der durch mRNA-LNP-Impfstoffe beim Menschen ausgelösten Entzündungsreaktionen zu bestimmen, um festzustellen, inwieweit es Überschneidungen, mit den für Mäuse dokumentierten Entzündungssignaturen geben könnte, wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
Frage 20: Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 7) bleibt noch zu klären, wie Lipidnanopartikel oder ihre ionisierbare Lipidkomponente, wie ALC-0315, verschiedene Entzündungswege aktivieren, wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
Frage 21: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben einige Unsicherheiten bezüglich der langen Halbwertszeit von ALC-0315. Laut Angaben Sonia Ndeupen et al. (Dezember 2021) (Seite 7) wird von der EMA „vermutet“, dass das synthetische, ionisierbare Lipid im Pfizer SARS-CoV-2-Impfstoff eine Halbwertszeit von etwa 20 - 30 Tagen im Menschen hat (Comirnaty, 2021). Ob das langfristige Vorhandensein ionisierbarer Lipide zu einem niedrigen Niveau chronischer Entzündungen und einer Erschöpfung des Immunsystems führen könnte, muss noch ermittelt werden. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage in der Studie Sonia Ndeupen et al. (Dezember 2021)?
Frage 22: Laut Angaben Xucheng Hou et al. (Dezember 2021) können Anti-PEG-Antikörper im Organismus zu einer schnellen systemischen Clearance von verabreichten PEGylierten Nanopartikeln, wie ALC-0159, durch eine beschleunigte Blut-Clearance führen. Das Phänomen der beschleunigten Blutausscheidung kann die Bioverfügbarkeit und die biologische Verteilung des in PEGylierten Nanopartikeln verkapselten Arzneimittels verändern und somit Nebenwirkungen verursachen. Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht? (Bitte um Übermittlung der Unterlagen)
Frage 23: Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315, die Sekretion von entzündungsfördernden Zytokinen stimulieren. Laut Angaben Robert J. Dunlop et al. (2000) spielen pro-inflammatorische Zytokine eine wichtige Rolle bei der Förderung des Wachstums und der Ausbreitung von Krebserkrankungen. Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht? (Bitte um Übermittlung der Unterlagen)
Frage 24: Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff, die Sekretion von reaktiven Sauerstoffspezies stimulieren. Dies verursacht oxidativen Stress Laut Angaben Mehdi Sharifi-Rad et al. (2020) spielt oxidativer Stress eine wesentliche Rolle bei der Entstehung chronischer Krankheiten wie Krebs, Herz-Kreislauf-Erkrankungen, Diabetes und neurodegenerativen Erkrankungen. Oxidativer Stress soll auch dem zentralen Nervensystem schaden und zu Krankheiten wie Schlaganfall, Parkinson oder Alzheimer führen können (siehe auch oben im Text unter Nr. 24). Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht? (Bitte um Übermittlung der Dokumente)
Frage 25: Die Sekretion von Zytokinen und reaktiven Sauerstoffspezies, die durch kationische Lipide, wie ALC-0315, stimuliert wird, kann zur Entstehung von kardiovaskulären Erkrankungen wie Myokarditis führen, die auch Herzstillstände mit Todesfolge verursachen kann. Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht? (Bitte um Übermittlung der Dokumente)
Frage 26: Eine abnorm hohe Zahl an Thrombozyten spielt bei der Entstehung der Gefäßverkalkung (Arteriosklerose) oder von Gefäßverschlüssen, wie dem Herzinfarkt, eine zentrale Rolle – siehe auch oben im Text Nr. 26. Wurde dies im Zusammenhang mit kationischen Lipiden wie ALC-0315 vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht? (Bitte um Übermittlung der Dokumente)
Frage 27: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Kationische Lipide wie ALC-0315 können die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies stimulieren von diesen Auswirkungen könnten auch Endothelzellen betroffen sein. Wurde dies vom BASG im Rahmen von Obduktionen an Personen, die in zeitlicher Nähe zur Verabreichung des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty verstorben waren, untersucht? (Bitte um Übermittlung der Dokumente)
Frage 28: Das Dahinscheiden von betagten Personen, in zeitlicher Nähe zur Impfung zum Schutz vor COVID-19, könnte ein Alarmsignal sein. Betagte Personen befinden sich oft in einem schlechteren gesundheitlichen Zustand und versterben daher vielleicht schneller an den Folgen von oxidativem Stress, der durch kationische Lipide, wie z.B. ALC-0315, durch die Sekretion von reaktiven Sauerstoffspezies, ausgelöst werden kann. Dies ist wegen der, laut EMA, verbleibenden Unsicherheiten bezüglich der langen Halbwertszeit von ALC-0315 EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) von besonderer Bedeutung. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 28 a.: Nachdem der Bayer AG laut Deutschem Ärzteblatt[34] 52 Todesfälle, 5 davon in Deutschland, in einem zeitlichen Zusammenhang mit der Einnahme des Cholesterinsynthesehemmers Cerivastatin gemeldet worden waren, erfolgte ein Verkaufsstopp des Cholesterinsenkers Cerivastatin. In zeitlicher Nähe zur Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs wurden in Österreich bis 22.04.2022 in Summe 216 Todesfälle gemeldet. Warum wurde die Verabreichung von Pfizer/BioNTech Comirnaty nicht gestoppt?
Frage 29:
Welche Dokumente und Stellungnahmen sind zu den oben angeführten Impfchargennummern verfügbar
a. ET7205
b. EW2239
c. EW2246
d. EW4815
e. FC2473
(OMCL`s, Europäisches Direktorat für die Qualität von Arzneimitteln - EDQM, Bundesministerium, BASG/AGES MEA)? (Bitte um Übermittlung der Unterlagen)
Frage 30: Zu welchen Impfchargennummern von Grippeimpfstoffen wurde in der Vergangenheit, eine ähnlich hohe Anzahl an Todesfällen, in zeitlicher Nähe zur Verabreichung eines Vakzins gemeldet, wie es beim Pfizer/BioNTech COVID-19 Impfstoff nun der Fall ist? (Wir bitten das Bundesministerium nicht auf Studien zum Pfizer/BioNTech COVID-19 Impfstoff aus dem Ausland wie z.B. von Pfizer/BioNTech zu verweisen, sondern österreichspezifische Daten und Fakten zu übermitteln und mit österreichischen Daten zu den Grippeimpfstoffen zu vergleichen.)
a. Wie sind die Gesamtzahlen im Vergleich?
b. Wie sind die Vergleichswerte pro 100.000 Impfungen?
Frage 31: Wie das US-Department of Justice[35] am 02.09.2009 bekannt gab, wurde das Pharmaunternehmen Pfizer zur Zahlung einer Strafe von 2,3 Milliarden USD wegen betrügerischem Marketing verurteilt. Warum kauft der österreichische Staat vorzugsweise die COVID-19 mRNA-Impfdosen von Pfizer/BioNTech mit Bezug auf die Verlautbarung des US-Department of Justice zum Pharmaunternehmen Pfizer (siehe auch oben Punkt 31)?
Frage 32: Die funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 wurden von der EMA daher als neuartige, medizinische Hilfsstoffe eingestuft, wie lautet die Stellungnahme des Bundesministeriums zu den Punkten im Text unter Nr. 32?
Frage 32 a.: Wie lautet, die Stellungnahme des Bundesministeriums zu dem Widerspruch wie oben unter 32 a. beschrieben wird?
Frage 33: Laut EMA wird die Qualität des neuartigen, medizinischen Hilfsstoffs funktionelles, kationisches Lipid ALC-0315, aufgrund der Nichterfüllung der spezfischen Verpflichtung (SO2) im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) und den Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 24), von der EMA als nicht akzeptabel angesehen – siehe oben im Text Nr. 33. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 33 a.: Zu ALC-0315 liegen nur begrenzte Erfahrungen vor und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315 (Seite 134) – siehe auch im Text Nr. 33 a. Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Frage 33 b.: Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 34: Der aktuelle Status der spezifischen Verpflichtung (SO4) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) mit „nicht erfüllt“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 34 a.: Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Frage 34 b.: Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 35: Der aktuelle Status der spezifischen Verpflichtung SO4 (e) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 8) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 35 a.: Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
35 b.: Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 36: Der aktuelle Status der spezifischen Verpflichtung SO4 (h) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 36 a.: Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Frage 36 b. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 37: Der aktuelle Status der spezifischen Verpflichtung SO4 (i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?[36]
Frage 37 a.: Die EMA verfügt aufgrund des Vermerks „fortlaufend“ zur spezifischen Verpflichtung SO4(i) bisher über keine vollständigen Informationen zur Stabilität des neuartigen, medizinischen Hilfsstoffs funktionelles, kationisches ALC-0315 während der Lagerung. ALC-0315 ist zusammen mit Wasser und der mRNA im Kern der Lipidnanopartikel gelagert und es ist daher anscheinend nicht genau bekannt, wie ALC-0315 mit der mRNA und Wasser während der Lagerung intragieren könnte und wie sich dies auf die Wirksamkeit und Sicherheit des Pfizer/BioNTech COVID-19 Impfstoffs auswirken könnte. Linde Schoenmaker et al. (April 2021) haben die Instabilität von mRNA-Impfstoffen untersucht. Die mRNA-Hydrolyse (Spaltung einer chemischen Verbindung durch Reaktion mit Wasser) ist der entscheidende Faktor für die mRNA-LNP-Instabilität. Derzeit ist unklar, wie Wasser im LNP-Kern mit der mRNA interagiert und inwieweit, die für den Abbau anfälligen Stellen der mRNA durch eine Hülle aus kationischen Lipiden geschützt sind. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 37 b.: Warum kann die Verwendung von ALC-0315 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Frage 38: Der aktuelle Status der spezifischen Verpflichtung SO5 mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles PEGyliertes Lipid ALC-0159, wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 9) mit „nicht erfüllt“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 38 a.: Warum kann die Verwendung von ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Frage 38 b.: Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 39: Der aktuelle Status der spezifischen Verpflichtung SO5 (e) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles PEGyliertes Lipid ALC-0159, wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 39 a.: Warum kann die Verwendung von ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Frage 39 b. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 40: Der aktuelle Status der spezifischen Verpflichtung SO5 (h) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159, wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 40 a.: Warum kann die Verwendung von ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Frage 40 b.: Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 41: Der aktuelle Status der spezifischen Verpflichtung SO5 (i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles PEGyliertes Lipid ALC-0159, wurde im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 10) mit „fortlaufend“ vermerkt. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 41 a.: Warum kann die Verwendung von ALC-0159 im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses Sachverhalts als völlig unbedenklich und sicher eingestuft werden?
Frage 41 b.: Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt mit Bezug auf die Wirksamkeit und Sicherheit des Fertigprodukts Pfizer/BioNTech COVID-19 Impfstoff Comirnaty?
Frage 42: Wie stehen die Angaben zu den spezifischen Verpflichtungen SO2, SO4, SO4(e), SO4(h), SO4(i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, kationisches Lipid ALC-0315 und die Angaben zu den spezifischen Verpflichtungen SO5, SO5(e), SO5(h), SO5(i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 im EMA Assessment Report Comirnaty (19.02.2021) und im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) im Einklang mit der EMA Leitlinie Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT (Seite 5) c) "pharmazeutische Hilfsstoffe, die in keinem Arzneibuch beschrieben sind: (Wie oben unter 42 angeführt)"?
Frage 42 a.: Die Angaben zu den spezifischen Verpflichtungen SO2, SO4, SO4(e), SO4(h), SO4(i) mit Bezug auf den neuartigen, medizinischen Hilfsstofffunktionelles, kationisches Lipid ALC-0315 und die Angaben zu den spezifischen Verpflichtungen SO5, SO5(e), SO5(h), SO5(i) mit Bezug auf den neuartigen, medizinischen Hilfsstoff funktionelles, PEGyliertes Lipid ALC-0159 im EMA Assessment Report Comirnaty (19.02.2021) und im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) stellen einen Widerspruch zur EMA Leitlinie Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT (Seiten 5 u. 6) Absatz „4.6 Neuartige Hilfsstoffe (3.2.P.4.6) „Für neuartige, pharmazeutische Hilfsstoffe sollten entsprechend dem Format des Arzneimittels vollständige Angaben zu Herstellung, Charakterisierung und Kontrollen mit Querverweisen auf unterstützende Sicherheitsdaten gemacht werden. a) Es sollte eine detaillierte Beschreibung des Hilfsstoffs, seiner Funktion und seiner Verwendungsbedingungen vorgelegt werden. Ist der Hilfsstoff komplex oder besteht er aus einem Gemisch von Verbindungen, sollte die Zusammensetzung in qualitativer und quantitativer Hinsicht angegeben werden.“ usw. dar. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Widerspruch?
42 b.: Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt beschrieben oben im Text unter Nr. 42 b.?
43 a: Laut EMA Assessment Report (19.02.2021) (Seite 41) wurden mit BNT162b2 auch keine sekundären pharmakodynamischen, oder pharmakodynamischen Arzneimittelwechselwirkungsstudien durchgeführt, da es sich, laut EMA, um ein RNA-basiertes Impfstoffprodukt handelt, das den geltenden Leitlinien, aus dem Jahr 2005 - WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 entspricht, die aus einer Zeit stammen, in der mRNA-Impfstoffe noch in der Erprobung waren und in der noch nicht einmal bedingt zugelassene mRNA-Impfstoffe an Menschen verabreicht wurden. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Art der Vorgehensweise der EMA bei der Bewertung des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty, der auf einer völlig neuartigen Impfstoffplattformtechnologie basiert?
Frage 44: Wie lautet die Stellungnahme des Bundesministeriums zu den Aussagen – im EMA Assessment Report Comirnaty (19.02.2021) und zu den Aussagen in der gültigen WHO Leitlinie: WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005, unter Absatz 4.2.3 mit Bezug auf neuartige, pharmazeutische Hilfsstoffe wie ALC-0315 und ALC-0159 in Impfstoffen – siehe auch genaue Beschreibung unter der Nr. 44 im Text?
Frage 44 a.: Warum hat die EMA den „Verweis“ EMA Assessment Report Comirnaty (19.02.2021) (Seite 45) des Antragstellers BioNTech mit Bezug auf den Entfall von Studien zur Sicherheitspharmakologie, ein Teil dieser Studien sind Genotoxizitäts- und Karzinogenitätsstudien, akzeptiert. Dieser „Verweis“ betraf nicht nur den Pfizer/BioNTech COVID-19 Impfstoff Comirnaty, sondern auch die neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159. Die WHO erklärt unter Absatz 4.2.3 in der Leitlinie: WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005, dass Impfstoffe bestimmte Impfstoffkomponenten, wie neuartige Adjuvantien und Zusatzstoffe enthalten können. Falls erforderlich, gibt die WHO zu bedenken, sollten, mit Bezug auf neuartige Adjuvantien und Zusatzstoffe in-vitro-Tests für Mutationen und Chromosomenschäden durchgeführt werden, bevor die erste Exposition gegenüber dem Menschen stattfindet. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 45: Wie lautet die Stellungnahme des Bundesministeriums zu dem Sachverhalt beschrieben unter der Nr. 45 oben im Text?
Frage 46: Wie lautet die Stellungnahme des Bundesministeriums zu den oben im Text unter Nr. 46 angeführten Angaben der EMA mit Bezug auf Genotoxiziät und Karzinogenität hinsichtlich der neuartigen, funktionellen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159, im EMA Assessment Report Comirnaty (19.02.2021) (Seiten 24, 56), im EMA Assessment Report über die jährliche Erneuerung der bedingten Zulassung für das Inverkehrbringen - Comirnaty (14.10.2021) (Seite 6), im EMA: Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan 25.11.2021 (Seiten 35, 37) und dem Widerspruch dieser Angaben zu den Ausführungen der WHO zu neuartigen, medizinischen Hilfsstoffen in der WHO Leitlinie: WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 Absatz 4.2.3?
Frage 47: Laut Eupati zeigen Studien zur Sicherheitspharmakologie, ob damit zu rechnen ist, dass sich ein Arzneimittel bei Verabreichung an Menschen im therapeutischen Bereich als unsicher herausstellt. Durch Studien zur Sicherheitspharmakologie soll die Verwendung unsicherer Arzneimittel verhindert werden. Warum wird der Pfizer/BioNTech COVID-19 Impfstoff, trotz des Entfalls von Studien zur Sicherheitspharmakologie als sicher bezeichnet?
Frage 48: Warum wird trotz der Informationen unter Nr. 48 im Text der Pfizer/BioNTech COVID-19 Impfstoff trotz des Entfalls von Studien zur Genotoxizität mit Bezug auf den neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315 als sicher bezeichnet?
Frage 48 a.: Warum beruft sich die EMA mit Bezug auf den Entfall von Genotoxizitätsstudien hinsichtlich der neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 auf die international gültige Richtlinie zur präklinischen Impfstoffentwicklung WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005 wenn unter Absatz 4.2.3 mit Bezug auf neuartige, medizinische Hilfsstoffe die Durchführung von Studien zur Genotoxizität empfohlen werden?
Frage 49: Warum wird der Pfizer/BioNTech COVID-19 Impfstoff trotz des Entfalls von Studien zur Karzinogenität mit Bezug auf den neuartigen, medizinischen Hilfsstoff kationisches Lipid ALC-0315 – wie im Text oben unter der Nr. 49 ausgeführt – als sicher bezeichnet?
Frage 49 a.: Warum beruft sich die EMA mit Bezug auf den Entfall zu Karzinogentätsstudien hinsichtlich der neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 auf die international gültige Leitlinie zur präklinischen Impfstoffentwicklung der WHO WHO guideline on nonclinical evaluation of vaccines - WHO Technical Report Series, No. 927, 2005, wenn unter Absatz 4.2.3 mit Bezug auf neuartige, medizinische Hilfsstoffe die Durchführung von Studien zur Genotoxizität und Karzinogenitität empfohlen wird?
Frage 50: Laut EMA Dokument: ICH Topic S 4 Duration of Chronic Toxicity Testing in Animals (Rodent and Non Rodent Toxicity Testing haben Studien zur Untersuchung der chronischen Toxizität jedoch eine Dauer von 6 Monaten bei Nagetieren und 9 Monate bei Nichtnagetieren, weitere Daten zu diesen Sachverhalten – siehe Text oben Nr. 50. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 50 a.: Wie lautet die Stellungnahme des Bundesministeriums mit Bezug auf die äußerst kurze Zeitdauer der Studien 38166 und 20GR142 zur Toxizität von 17 Tagen + 3 Wochen Erholungsphase mit Bezug auf die Sicherheit des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty?
Frage 50 b.: Aus welchen Studien, Risikobewertungen und Dokumenten der Impfstoffhersteller BioNTech - Pfizer Inc. geht hervor, dass mit Toxizitätsstudien, die eine Zeitdauer von nur 17 Tagen + 3 Wochen Erholungsphase umfassten, die völlige Unbedenklichkeit des neuartigen, medizinischen Hilfsstoffs ALC-0315, aber auch des neuartigen, medizinischen Hilfsstoffs ALC-0159 einwandfrei und lückenlos belegt werden kann? (Bitte um Übermittlung der Unterlagen)
Frage 50 c.: Die Halbwertszeit von ALC-0315 ist nicht geklärt und es ist nicht bekannt, für welchen Zeitraum ALC-0315 im Organismus verbleibt, wie konnte aufgrund dieser Tatsachen, eine umfassende Risikobewertung des neuartigen, medizinischen Hilfsstoffs ALC-0315 durchgeführt werden, wenn die Studien zur Toxizität laut EMA Comirnaty Risk Management Plan (25.11.2021) (Seite 35) nur eine Zeitdauer von 17 Tagen + 3 Wochen Erholungsphase hatten (Näheres siehe auch oben im Text unter 50 c.)?
Frage 50 d.: Warum wurden keine Studien zur chronischen Toxizität zur Risikobewertung des neuartigen, medizinischen Hilfsstoffs ALC-0315 durchgeführt?
Frage 51: Wurde das Risiko der Zytotoxizität, die durch kationische Lipide, wie ALC-0315, durch die Stimulation von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies verursacht wird, von den Impfstoffherstellern BioNTech - Pfizer Inc. im Rahmen der Risikobewertungen im EMA Comirnaty Risk Management Plan (25.11.2021) überhaupt untersucht, wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 52: Wie lautet die Stellungnahme des Bundesministeriums, können Präimplantationsverluste nach der Verabreichung von Pfizer/BioNTech Comirnaty an Menschen gänzlich ausgeschlossen werden (wie oben im Text unter der Nr. 52 argumentiert wird)?
Frage 52 a.: Laut Angaben Aleisha R. Brock et al. (Oktober 2021) (Seite 135) gab es geringe Indizien für Gastroschisis, Mund-/Kieferfehlbildungen, rechtsseitigem Aortenbogen und Anomalien der Halswirbelsäule in den Föten der Versuchstiere. Wie lautet die Stellungnahme des Bundesministeriums, kann gänzlich ausgeschlossen werden, dass die Verabreichung von Pfizer/BioNTech Comirnaty die beschriebenen Missbildungen in menschlichen Föten nicht verursacht?
Frage 52 b.: Laut Angaben Aleisha R. Brock et al. (Oktober 2021) (Seite 135) wurde in der Pfizer/BioNTech DART-Studie, die auch im EMA Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) angegeben wurde, der plazentare Transfer von mRNA im Pfizer/BioNTech COVID-19 Impfstoff nicht untersucht. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt, warum wurde dies von den Impfstoffherstellern BioNTech - Pfizer Inc. nicht untersucht?
Frage 53: Laut Angaben Aleisha R. Brock et al. (Oktober 2021) (Seite 136) sind Studien erforderlich um festzustellen, ob das mRNA-kodierte Spike-(S)-Protein nach der Verabreichung von Pfizer/BioNTech Comirnaty die Fähigkeit besitzt Syncytin-1 zu hemmen und damit die, für die Plazentaanhaftung erforderliche Zellfusion verhindern könnte, was zu einem Schwangerschaftsverlust führen kann. Über diese Form der Toxizität, die durch kationische Lipide, wie ALC-0315, verursacht werden kann, sind im EMA Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) keine Angaben zu finden. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 53 a.: Laut Angaben von R. Tenchov et al. (Juni 2021) können kationische Lipide, wie ALC-0315, die Mitose in Zellen reduzieren. Die Folge einer Mitosehemmung sind polyploide Zellkerne, in denen ein vielfacher Chromosomensatz vorliegt, z. B. ein dreifacher oder ein vierfacher Chromosomensatz. Für den Menschen ist Polyploidie tödlich: Neugeborene, die aufgrund einer fehlerhaften Zellteilung im frühen Entwicklungsstadium oder wegen eines defekten Spermiums oder Eizelle mit dreifachem Chromosomensatz (Triploidie) zur Welt kommen, sterben meist bei der Geburt oder werden tot geboren. Über diese Form der Toxizität, die durch kationische Lipide, wie ALC-0315, verursacht werden kann, sind im EMA Comirnaty (COVID-19 mRNA Vaccine) Risk Management Plan (25.11.2021) keine Angaben zu finden. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 54: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 45) hat der Antragsteller in der Studie PF-07302048_06Jul20_072424 eine qualifizierte LC-MS/MS-Methode verwendet, um die Quantifizierung der beiden neuartigen LNP-Hilfsstoffe (ALC-0315 und ALC-0315) zu unterstützen. Laut EMA hat es jedoch nur den „Anschein“, dass Bioanalysemethoden für die Verwendung in den Good Laboratory Practice-Studien vom Antragsteller angemessen beschrieben und validiert wurden. Wenn etwas den „Anschein“ hat, ist das kein wissenschaftlicher Beweis. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage im EMA Assessment Report Comirnaty (19.02.2021) (Seite 45)?
Frage 55: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) „scheint“ es so, dass nach der Plasma-Clearance die Leber das Hauptorgan ist, an das sich ALC-0315 und ALC-0159 verteilen. Der Antragsteller „schätzt“ den Prozentsatz, der in der Leber verteilten Dosis auf ~60% für ALC-0315 und ~20% für ALC-0159. Mit Bezug auf die neuartigen, medizinischen Hilfsstoffe ALC-0315 und ALC-0159 „scheint“ der EMA etwas so zu sein. Das ist keine Angabe, die auf eindeutigen, wissenschaftlichen Fakten beruht. Sie ist eine Vermutung. Die Schätzung des Antragstellers ist keine präzise Angabe. Wie lautet die Stellungnahme des Bundesministeriums zu diesen Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 46)?
Frage 56: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) wurde der Antragsteller gebeten, die lange Halbwertszeit von ALC-0315 und dessen Wirkung, den Vergleich mit Patisiran, sowie die Auswirkungen auf die Boosts und die Dauer der Empfängnisverhütung nach der Behandlung zu erörtern. Der Antragsteller war der „Auffassung“, dass es auf der Grundlage der von ihm durchgeführten Studien zur Toxizität, bei wiederholter Verabreichung in Dosen (auf mg/kg-Basis), die weit über den beim Menschen verabreichten liegen, keine nichtklinischen Sicherheitsprobleme gäbe und diese „Auffassung“ des Antragstellers hat die EMA akzeptiert. Eine „Auffassung“ ist eine persönliche Ansicht, aber kein wissenschaftlicher Beweis. Wie lautet die Stellungnahme des Bundesministeriums zu dieser Aussage im EMA Assessment Report Comirnaty (19.02.2021) (Seite 46)?
Frage 57: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) betrug der Prozentsatz der unverändert mit den Fäkalien ausgeschiedenen Dosis ~1% für ALC-0315 und ~50% für ALC-0159. Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien nachgewiesen wurde, „könnte“ der Stoffwechsel laut EMA eine größere Rolle bei der Ausscheidung von ALC-0315 als von ALC-0159 spielen. Mit Bezug auf die Ausscheidung von ALC-0315 äußert die EMA eine Vermutung. Eine Vermutung ist kein wissenschaftlicher Beweis, der auf zuverlässigen, wissenschaftlichen Daten basiert. Wielautet die Stellungnahme des Bundesministeriums zu dieser Aussage im EMA Assessment Report Comirnaty (19.02.2021) (Seite 48)?
Frage 57 a.: Bezugnehmend auf die Argumente im oberen Text unter der Nr. 57 a.: Warum wird der Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieses eklatanten Sicherheitsmangels als sicher bezeichnet?
Frage 58: Es wurde nur eine „begrenzte Absorptionsstudie/Verteilungsstudie vorgelegt, die Studien zur Toxikologie umfassten nur die Zeitdauer von 17 Tagen + 3 Wochen Erholungsphase – siehe oben Text Nr. 58. Aufgrund der Nichterfüllung der spezifischen Verpflichtung 2 (SO2) wird die Qualität des medizinischen Hilfsstoffs ALC-0315 von der EMA als nicht akzeptabel angesehen. Warum wird der Pfizer/BioNTech COVID-19 Impfstoff Comirnaty trotz dieser eklatanten Sicherheitsmängel als sicher bezeichnet?
Frage 59: Warum wurden im EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) Daten zur durchschnittlichen Gesamtlipidkonzentration an ALC-0315 und ALC-0159 in der Leber der Versuchstiere veröffentlicht, die nicht mit den Angaben zur durchschnittlichen Gesamtlipidkonzentration in der Pfizer Studie PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary1 (Seite 7) übereinstimmen (siehe auch oben im Text unter der Nr. 59), wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 59 a.: Welche Risikobewertungen, Studien, Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. geben Auskunft, innerhalb welcher genauen Zeitspanne, nach der Verabreichung des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty, der neuartige, medizinische Hilfsstoff ALC-0315, vollständig aus der Leber eliminiert wird? (Bitte um Übermittlung der Unterlagen)
Frage 59 b.: Wird der neuartige, medizinische Hilfsstoff ALC-0315 überhaupt vollständig aus der Leber eliminiert (siehe auch oben im Text Nr. 59 b.)?
Frage 59 c.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) existieren zum neuartigen, medizinischen Hilfsstoff ALC-0315 nur begrenzte Erfahrungen und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315, warum wird der Pfizer/BioNTech COVID-19 Impfstoff trotz dieses Sachverhalts (wie oben im Text unter der Nr. 59 c. geschildert) als sicher bezeichnet?
Frage 59 d.: Laut Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary 2 (Seite 5) war der Konzentrationswert an ALC-0315 in der Leber der Versuchstiere nach über 300 Stunden beinahe ident mit dem Konzentrationswert nach 200 Stunden. Welche Studien, Risikobewertungen und Dokumente mit Bezug auf Konzentrationswerte an ALC-0315, in der Leber der Versuchstiere, nach z.B. 2000, 4000 Stunden liegen von den Impfstoffherstellern BioNTech - Pfizer Inc. vor? (Bitte um Übermittlung der Unterlagen)
Frage 59 e.: Die Angaben zur Konzentration an ALC-0315 in der Leber der Versuchstiere im EMA Assessment Report Comirnaty (19.02.2021) passen nicht zu den Angaben im Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary2 – siehe auch oben im Text die Nr. 59 e. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 59 f.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 53) hat ALC-0315 hat keine bekannte Biologie. In Ermangelung dieser "biologischen Relevanz" hatte der Antragsteller eine „Schätzung“ von >95 % Ausscheidung von ALC-0315 verwendet, um die wesentliche Ausscheidung aus dem Körper darzustellen. Die Eliminationshalbwertszeit von ALC-0315 in der Leber nach intravenöser Verabreichung an die Ratte beträgt, laut EMA, etwa 6-8 Tage. Diese Angaben zur Eliminationshalbwertszeit von ALC-0315 in der Leber der Versuchstiere im EMA Assessment Report Comirnaty (19.02.2021) passen nicht zu den Angaben zur Konzentration an ALC-0315 im Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary2 – siehe auch oben im Text die Nr. 59 f. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 60: Haben die Impfstoffhersteller BioNTech - Pfizer Inc. im Rahmen von Studien zur Toxikologie untersucht, ob das Aufkommen von Myokarditis oder Perikarditis, nach der Verabreichung von Pfizer/BioNTech Comirnaty, im Zusammenhang mit der proinflammatorischen Wirkung des kationischen Lipids ALC-0315 steht?
Frage 60 a.: Welche Studien, Dokumente und Risikobewertungen der Impfstoffhersteller BioNTech - Pfizer Inc. dokumentieren, innerhalb welcher genauen Zeitspanne ALC-0315 vollständig aus dem Organ Herz eliminiert wird? (Bitte um Übermittlung der Dokumente)
Frage 60 b.: Wird der neuartige, medizinische Hilfsstoff ALC-0315 überhaupt vollständig aus dem Organ Herz eliminiert?
Frage 60 c.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) liegen zum neuartigen, medizinischen Hilfsstoff nur begrenzte Erfahrungen vor und es verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Wird ALC-0315 nicht vollständig aus dem Organ Herz eliminiert, könnte ALC-0315, nach der Verabreichung von Pfizer/BioNTech Comirnaty, durch die Sekretion von proinflammatorischen Zytokinen und reaktiven Sauerstoffspezies permanent Herzmuskelentzündungen und Herzbeutelentzündungen verursachen. Wie lautet die Stellungnahme zu diesem Sachverhalt mit Bezug auf die Sicherheit des Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty?
Frage 60 d.: Laut Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary 2 (Seite5) war der Konzentrationswert an ALC-0315 in der Leber der Versuchstiere nach über 300 Stunden beinahe ident mit dem Konzentrationswert nach 200 Stunden. Wurde der Konzentrationswert an ALC-0315 im Herz der Versuchstiere nach 300 Stunden, im Rahmen von Studien zur Toxikologie, überhaupt von den Impfstoffherstellern BioNTech - Pfizer Inc. untersucht? (Bitte um Übermittlung der Unterlagen)
Frage 60 e.: Welche Studien, Risikobewertungen und Dokumente mit Bezug auf Konzentrationswerte an ALC-0315, im Herz der Versuchstiere, nach z.B. 2000, 4000 Stunden liegen von den Impfstoffherstellern BioNTech - Pfizer Inc. vor? (Bitte um Übermittlung der Unterlagen)
Frage 61: Laut Pfizer Dokument: PF-07302048_06Jul20_072424 - module 2.6.5. pharmacokinetics tabulated summary 1 (Seiten 7 u. 8) wurde in den Nebennieren, Knochen (Oberschenkel), Knochenmark (Oberschenkel), Augen, Lymphknoten (Unterkiefer), Lymphknoten (Bauchfell), Eierstöcken, Milz, Hoden, Uterus der Versuchstiere - Wistar Han Ratten während des gesamten, von Pfizer/BioNTech angegebenen Beobachtungszeitraums, von 48 Stunden, die höchste durchschnittliche Gesamtlipidkonzentration an ALC-0315 und ALC-0159 nach 48 Stunden erreicht. Wurde die durchschnittliche Gesamtlipidkonzentration an ALC-0315 und ALC-0159 von den Impfstoffherstellern BioNTech - Pfizer Inc. auch über eine längeren Beobachtungszeitraum als 48 Stunden untersucht? (Bitte um Übermittlung der Unterlagen)
Frage 61 a.: Sollte ALC-0315 nicht aus dem Organismus eliminiert werden, kann die Sekretion von entzündungsfördernden Zytokinen und reaktiven Sauerstoffspezies, die durch ALC-0315 stimuliert wird, zu einer Vielzahl an Krebserkrankungen z.B. in den Nebennieren, Knochen, Knochenmark, den Lymphknoten, den Eierstöcken, der Milz, den Hoden, im Uterus etc. führen. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 61 b.: Laut Pfizer Dokument BNT162b2 Module 2.6.4. Pharmacokinetics Written Summary 2 (Seite5) war der Konzentrationswert an ALC-0315 in der Leber der Versuchstiere nach über 300 Stunden beinahe ident mit dem Konzentrationswert nach 200 Stunden. Welche Studien, Risikobewertungen und Dokumente zu den Konzentrationswerten an ALC-0315, nach z.B. 2000, 4000 Stunden etc. in den Nebennieren, Knochen (Oberschenkel), Knochenmark (Oberschenkel), Augen, Lymphknoten (Unterkiefer), Lymphknoten (Bauchfell), Eierstöcken, Milz, Hoden, Uterus der Versuchstiere liegen von den Impfstoffherstellern BioNTech - Pfizer Inc. vor? (Bitte um Übermittlung der Unterlagen)
Frage 62: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 46) war von den Lipiden ALC-0315 und ALC-0159 keine Ausscheidung im Urin der Versuchstiere nachweisbar. Der Prozentsatz der unverändert mit den Fäzes ausgeschiedenen Dosis betrug ~1 % für ALC-0315 und ~50% für ALC-0159. (Seite 48) Da fast kein unverändertes ALC-0315 im Urin oder in den Fäkalien der Versuchstiere nachgewiesen wurde, spielt der Stoffwechsel möglicherweise eine größere Rolle bei der Ausscheidung von ALC-0315 eine größere Rolle spielen als bei ALC-0159. Welche genaue Rolle spielt der Stoffwechsel bei der Ausscheidung von ALC-0315? Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen vor? (Bitte um Übermittlung der Unterlagen)
Frage 62 a.: Laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134) verbleiben einige Unsicherheiten hinsichtlich der langen Halbwertszeit von ALC-0315. Wird ALC-0315 über den Stoffwechsel überhaupt völlig ausgeschieden? Verbleibt ein Teil an ALC-0315 für unbestimmte Zeit im Organismus? Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech Pfizer Inc. liegen vor? (Bitte um Übermittlung der Unterlagen)
Frage 62 b.: Welche Studien, Risikobewertungen und Dokumente zur exakten Halbwertszeit und zu den exakten Eliminationszeiten von ALC-0315 liegen von den Impfstoffherstellern BioNTech - Pfizer Inc. vor? (Bitte um Übermittlung der Unterlagen)
Frage 63: Wie wurde trotz fehlender Studien zur Genotoxizität und Karzinogenität, mit Bezug auf das kationische Lipid ALC-0315, im Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty, laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) der „less-than lifetime toxicological threshold of concern“ oder spezifische Konzentrationsgrenzwert (SCL) für den neuartigen, medizinischen Hilfsstoff ALC-0315 ermittelt?
Frage 63 a.: Aus dem Pfizer Sicherheitsdatenblatt Pfizer-BioNTech COVID-19 Vaccine Datenstand 07.12.2021 [37](Seiten 1 u. 2) geht hervor: „2.1. Einstufung des Stoffs oder Gemischs: GHS-Klassifizierung: Nicht als gefährlich klassifiziert, Hinweis: Dieses Dokument wurde in Übereinstimmung mit den Standards für Arbeitsplatzsicherheit erarbeitet, nach denen alle bekannten Gefahren des Produktes oder seiner Inhaltsstoffe ungeachtet des potentiellen Risikos genannt werden müssen. Die angegebenen Vorsichts- und Warnhinweise treffen möglicherweise nicht in jedem Falle zu. In Abhängigkeit von der potentiellen Exposition an ihrem Arbeitsplatz weichen Ihre Anforderungen möglicherweise von den Angaben ab.“ Aus dem WKO Leitfaden[38]: Das GHS-System in der Praxis geht hervor (Seite7): „Werden gefährliche Eigenschaften festgestellt, wird der Stoff oder das Gemisch entsprechend eingestuft. Die Hersteller, Importeure, nachgeschalteten Anwender (Formulierer) und Händler von Stoffen und Gemischen haben die Verpflichtung, die identifizierten Gefahren den Akteuren in der Lieferkette sowie den Konsumenten mitzuteilen.“ Das kationische Lipid ALC-0315 weist gefährliche Eigenschaften auf - Sonia Ndeupen et al. (Dezember 2021), sind diese den Impfstoffherstellern BioNTech - Pfizer Inc. nicht bekannt?
Frage 63 b.: Wie wurde trotz fehlender Studien zur Genotoxizität und Karzinogenität, mit Bezug auf das kationische Lipid ALC-0315, im Pfizer/BioNTech COVID-19 Impfstoffs Comirnaty, laut EMA Assessment Report Comirnaty (19.02.2021) (Seiten 50, 55, 56) der „less-than lifetime toxicological threshold of concern“ oder spezifische Konzentrationsgrenzwert (SCL) für den neuartigen, medizinischen Hilfsstoff ALC-0159 ermittelt?
Frage 63 c.: Die medizinischen Hilfsstoffe ALC-0315 2036272-55-4 und ALC-0159 1849616-42-7 werden im Pfizer Sicherheitsdatenblatt Pfizer-BioNTech COVID-19 Vaccine Datenstand 07.12.2021 unter Abschnitt 3: Zusammensetzung/Angaben zu Bestandteilen, von Pfizer, als ungefährliche Substanzen eingestuft und ein spezifischer Konzentrationsgrenzwert (SCL) wird daher nicht angegeben. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. sind zur Bestimmung des spezifischen Konzentrationsgrenzwerts (SCL) von ALC-0315 verfügbar und bestätigen einwandfrei, dass ALC-0315 als ungefährliche Substanz eingestuft werden kann? (Wir bitten um Übermittlung der Unterlagen)
Frage 63 d.: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. sind zur Bestimmung des spezifischen Konzentrationsgrenzwert (SCL) von ALC-0159 verfügbar und bestätigen einwandfrei, dass ALC-0159 als ungefährliche Substanz eingestuft werden kann? (Wir bitten um Übermittlung der Unterlagen)
Frage 63 e.: Im Sicherheitsdatenblatt des Herstellers Cayman Chemical - Datenstand 22.09.2021 war zum Produkt ALC-0315, das auch im Pfizer/BioNTech COVID-19 Impfstoff, laut Angaben Bundesministerium, in modifizierter/optimierter Form verwendet wird, vermerkt (Seiten 1 u. 2): "Einstufung des Stoffes oder Gemisches, GHS08 Gesundheitsgefahr, Carc. 1A H350 Kann Krebs verursachen." Welche Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. geben Aufschluss über den Prozess der Modifizierung und Optimierung des medizinischen Hilfsstoffs ALC-0315, der im Pfizer/BioNTech COVID-19 Impfstoff verwendet wird? (Wir bitten um Übermittlung der Unterlagen)
Frage 64: Laut Bundesministerium kann die Angabe von Substanzen in Sicherheitsdatenblättern nicht direkt auf deren Einsatz in Arzneimittel umgelegt werden, da diese Substanzen in der chemischen Industrie zum Beispiel (in welcher Sicherheitsdatenblätter erstellt werden) ein gänzlich anderes Anwendungsspektrum, als in der Arzneimittelherstellung besitzen. In welchem Anwendungsspektrum der chemischen Industrie kommen die medizinischen Hilfsstoffe ALC-0315 und ALC-0159 noch zum Einsatz? Wir ersuchen das Bundesministerium um eine detaillierte Auflistung. (Bitte um Übermittlung der Unterlagen)
Frage 65: In welchen anderen Medikamenten oder Impfstoffformulierungen mit bedingter oder vollständiger EMA Zulassung werden die pharmazeutischen Hilfsstoffe ALC-0315 und ALC-0159 noch verwendet? Wir ersuchen das Bundesministerium um eine detaillierte Auflistung (Bitte um Übermittlung der Unterlagen).
Frage 66: Langzeitstudien mit Versuchstieren wie Nagetieren und Nichtnagetieren zur Prüfung der chronischen Toxizität wurden laut Angaben im EMA Assessment Report Comirnaty (19.02.2021) (Seite 48) und im EMA Comirnaty Risk Management Plan 25.11.2021 (Seite 35) nicht durchgeführt, denn diese haben laut EMA Dokument: ICH Topic S 4 Duration of Chronic Toxicity Testing in Animals (Rodent and Non Rodent Toxicity Testing) bei Nagetieren eine Zeitdauer von 6 Monaten und bei Nichtnagetieren eine Zeitdauer von 9 Monaten. Die zwei Studien zur Toxizität an Verssuchtieren - Wistar Han Ratten hatten nur eine Zeitdauer von 17 Tagen + 3 Wochen Erholungsphase. Zum medizinischen Hilfsstoff kationisches Lipid ALC-0315 existieren, laut EMA Assessment Report Comirnaty (19.02.2021) (Seite 134), nur begrenzte Erfahrungen und es verbleiben einige Unsicherheiten bezüglich der langen Halbwertszeit von ALC-0315. Wie konnte trotz des Verzichts auf Langzeitstudien zur chronischen Toxizität der „less-than lifetime toxicological threshold of concern“ oder der spezifische Konzentrationsgrenzwert (SCL) von ALC-0315 ermittelt werden?
Frage 67: Das synthetische, kationische Lipid ALC-0315 (4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) bildet die Hauptkomponente des Lipidgemischs im Pfizer/BioNTech COVID-19 Impfstoff Comirnaty. Zum synthetischen, kationischen Lipid ALC-0315 (4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) wurden keine Angaben in der Guideline ICH M7(R2) gefunden. Dies ist auch nicht verwunderlich, da im EMA Assessment Report Comirnaty (19.02.2021) erklärt wird, dass zum kationischen Lipid ALC-0315 nur begrenzte Informationen (Seite 23) vorgelegt wurden, dass nur begrenzte Erfahrungen zu ALC-0315 vorliegen (Seite 134) und dass das kationische Lipid ALC-0315 ein neuartiger medizinischer Hilfsstoff ist, der bisher noch nicht in einem in der EU zugelassenen Medizinprodukt verwendet wurde (Seite 28). Dies trifft auch auf das synthetische, PEGylierte Lipid ALC-0159 zu. Auch zum PEGylierten Lipid ALC-0159 (2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide) wurden keine Angaben in der Guideline ICH M7(R2) gefunden. Wie lautet die Stellungnahme des Bundesministeriums zu diesem Sachverhalt?
Frage 67 a.: In der Guideline ICH M/(R2) wurden keine Angaben zu ALC-0315 (4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) gefunden. Welcher international definierte Grenzwert, mit Bezug auf den medizinischen Hilfsstoff ALC-0315 ist daher in der Guideline ICH M7(R2) vermerkt?
Frage 67 b.: In der Guideline ICH M/(R2) wurden keine Angaben zu ALC-0159 (2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide) gefunden. Welcher international definierte Grenzwert, mit Bezug auf den medizinischen Hilfsstoff ALC-0315 ist daher in der Guideline ICH M7(R2) vermerkt?
Frage 68: Wie lautet die Stellungnahme des Bundesministeriums zur oben angeführten Schilderung der Verursachung von Zytotoxizität (siehe oben Text Nr. 68), durch das kationische Lipid ALC-0315, mit Bezug auf die Sicherheit des COVID-19 Impfstoffs Pfizer/BioNTech Comirnaty?
Frage 68 a.: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. zur oben angeführten Schilderung der Verursachung von Toxizität durch das kationische Lipid ALC-0315 liegen mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) allgemein vor? (Bitte um Übermittlung der Unterlagen)
Frage 69: Laut Angaben Xucheng Hou et al. (Dezember 2021) können kationische Lipide, wie ALC-0315, die Sekretion von entzündungsfördernden Zytokinen stimulieren. Laut Angaben Robert J. Dunlop et al. (2000) spielen Zytokine eine wichtige Rolle bei der Förderung des Wachstums und der Ausbreitung von Krebserkrankungen. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen zu dieser Form der Toxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) vor? (Wir bitten um Übermittlung der Unterlagen)
Frage 70: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen zur Toxizität des kationischen Lipids ALC-0315, die durch die Stimulation der Sekretion von reaktiven Sauerstoffspezies und den dadurch verursachten oxidativen Stress, der laut Mehdi Sharifi-Rad et al. (2020) zu schweren Erkrankungen wie z.B.Krebs führt, mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) von ALC-0315 vor? (Wir bitten um Übermittlung der Unterlagen)
Frage 71: Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen hinsichtlich der oben genannten Zelltypen und der Zytotoxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) vor (siehe oben im Text unter Nr. 71)? (Wir bitten um Übermittlung der Unterlagen)
Frage 72: Laut Angaben Zhongjie Yu et al. (Mai 2020) bestehen nach wie vor Bedenken hinsichtlich der potenziellen toxikologischen Auswirkungen von Nanopartikeln, da sie eher dazu neigen, übermäßige Mengen an reaktiven Sauerstoffspezies (ROS) zu erzeugen. Aufgrund des starken Oxidationspotenzials können die von Nanopartikeln induzierten überschüssigen ROS zur Schädigung von Biomolekülen und Organellstrukturen führen und eine oxidative Carbonylierung von Proteinen, Lipidperoxidation, DNA/RNA-Bruch und die Zerstörung von Membranstrukturen bewirken, die wiederum Nekrose, Apoptose oder sogar Mutagenese verursachen. Welche Studien, Risikobewertungen und Dokumente der Impfstoffhersteller BioNTech - Pfizer Inc. liegen zu dieser Form der Toxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder den spezifischen Konzentrationsgrenzwert (SCL) vor? (Wir bitten um Übermittlung der Unterlagen)
Frage 73: Laut Angaben von R. Tenchov et al. (Juni 2021) können kationische Lipide, wie ALC-0315, die Mitose in Zellen reduzieren. Die Hemmung der Mitose verursacht Polyploidie, die für Kinder im Mutterleib immer tödlich verläuft und zu Fehlgeburten - Totgeburten führt. Wurde diese Form der Toxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder des spezifischen Konzentrationsgrenzwert (SCL) von den Impfstoffherstellern BioNTech - Pfizer Inc. ermittelt? (Bitte um Übermittlung der Unterlagen)
Frage 74: Laut Angaben von R. Tenchov et al. (Juni 2021) können kationische Lipide, wie ALC-0315, schädliche Auswirkungen auf zelluläre Schlüsselproteine haben, die eine entscheidende Rolle bei nahezu allen zellulären Funktionen haben. Wurde diese Form der Toxizität von ALC-0315 mit Bezug auf den „less-than lifetime toxicological threshold of concern“ oder des spezifischen Konzentrationsgrenzwert (SCL) von den Impfstoffherstellern BioNTech - Pfizer Inc. ermittelt? (Bitte um Übermittlung der Unterlagen)
Frage 75: Aus der EMA Richtline: Current effective version - Legal effective date 01/01/2008 London, 19 June 2007 Doc. Ref. EMEA/CHMP/QWP/396951/2006 - GUIDELINE ON EXCIPIENTS IN THE DOSSIER FOR APPLICATION FOR MARKETING AUTHORISATION OF A MEDICINAL PRODUCT geht hervor, dass für Hilfsstoffe, die in keinem Arzneibuch beschrieben sind, Reinheitstests, einschließlich Grenzwerten für Gesamt- und Einzelverunreinigungen durchgeführt werden sollten. Über welche Dokumente verfügen EMA, OMCL`s, Europäisches Direktorat für die Qualität von Arzneimitteln - EDQM zum „less-than lifetime toxicological threshold of concern“ und zum Specific concentration limit (SCL) - spezifischen Konzentrationsgrenzwert, mit Bezug auf den medizinischen Hilfsstoff ALC-0315? (Bitte um Übermittlung der Unterlagen)
Frage 75 a.: Über welche Dokumente verfügen EMA, OMCL`s, Europäisches Direktorat für die Qualität von Arzneimitteln - EDQM zum „less-than lifetime toxicological threshold of concern“ und zum Specific concentration limit (SCL) - spezifischen Konzentrationsgrenzwert, mit Bezug auf den medizinischen Hilfsstoff ALC-0159? (Bitte um Übermittlung der Unterlagen)
Frage 76: Wie konnten der „less-than lifetime toxicological threshold of concern“ "oder der spezifische Konzentrationsgrenzwert (SCL) für den neuartigen, medizinischen Hilfsstoff funktionelles kationisches Lipid ALC-0315 aufgrund der mangelhaften Datenlage laut Angaben im EMA Assessment Report Comirnaty (19.02.021) Seiten 23, 28, 48, 134 korrekt ermittelt werden (bitte beziehen Sie sich auf den Text oben unter der Nr. 76)?
Frage 76 a.: Wie konnten der „less-than lifetime toxicological threshold of concern“ oder der spezifische Konzentrationsgrenzwert (SCL) für den neuartigen, medizinischen Hilfsstoff funktionelles Lipid ALC- PEGyliertes Lipid ALC-0159 aufgrund der mangelhaften Datenlage laut Angaben im EMA Assessment Report Comirnaty (19.02.021) Seiten 23, 28, 48, 134 korrekt ermittelt werden?